Tetróxido de osmio
Tiempo de lectura estimado: 7 minutos
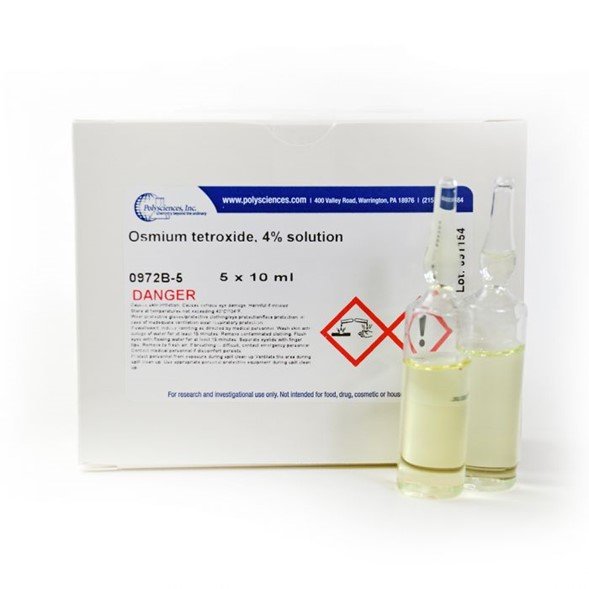
El tetróxido de osmio (óxido de osmio (VIII)) es el compuesto químico de fórmula OsO4. Este compuesto destaca por sus numerosos usos, a pesar de su toxicidad y de la rareza del osmio. También tiene una serie de propiedades inusuales, una de ellas es que el sólido es volátil.
El compuesto es incoloro, pero la mayoría de las muestras parecen amarillas, lo que probablemente se deba a la presencia de la impureza OsO2, que es de color amarillo-marrón. En biología, su propiedad de unirse a los lípidos lo ha convertido en una compuesto para tinción muy utilizado en microscopía electrónica.
Propiedades del tetróxido de osmio
El tetróxido de osmio es probablemente el compuesto más conocido del osmio, que puede encontrarse fácilmente, ya que se encuentra sólo dos puestos por debajo del hierro en la tabla periódica. El tetróxido de osmio está inextricablemente ligado al descubrimiento y posterior purificación del osmio.
El osmio es un metal escaso que sólo se encuentra en 0,005 ppm en la corteza terrestre. Tennant descubrió el osmio en 1803 en los residuos que quedaban al disolver el platino bruto y otros metales preciosos en agua regia (c.HNO3/c.HCl). Su nombre proviene de la palabra griega que significa olor (osme). El osmio también se encuentra, a menudo con el Ru y el Ir, en los lodos anódicos producidos durante la electrólisis de soluciones de Níquel (II). El osmio tiene una densidad excepcional de 22,57 g cm-3 y una p.m. muy elevada de 3045°C.
El tetróxido de osmio es un ejemplo de la mayor oxidación alcanzada por un elemento de transición. Al igual que el metano, el tetróxido de osmio tiene una geometría tetraédrica con un ángulo de enlace O-Os-O de aproximadamente 109,5°. Es un sólido cristalino extremadamente tóxico con una p.m. baja = 40°C y p.b. = 130°C. La potente combinación de alta toxicidad y volatilidad (se evapora fácilmente) hace que el tetróxido de osmio sea peligroso si no se almacena o manipula correctamente. Recientemente, los medios de comunicación han sugerido su uso como arma química de los «multimillonarios».
El tetróxido de osmio es muy soluble en CCl4 (tetracloruro de carbono) y moderadamente soluble en agua. El OsO4 tiene un olor característico parecido al del ozono. El olor es reconocible como el olor «fresco» que se percibe junto a las fotocopiadoras viejas, cerca de alguien que está soldando, o que se huele en un día soleado de verano en una ciudad muy congestionada.
El tetróxido de osmio es especialmente peligroso para los ojos, ya que los tejidos vivos lo reducen fácilmente para dar lugar a un óxido negro o al metal. Por este motivo, se le da un uso importante como tinción biológica cuando se encuentra en soluciones acuosas diluidas.
Usos del tetróxido de osmio
En la síntesis orgánica, el OsO4 se utiliza ampliamente para oxidar alquenos a los dioles vicinales, añadiendo dos grupos hidroxilos en el mismo lado (sin adición). Esta reacción se ha hecho tanto catalítica (dihidroxilación de Upjohn) como asimétrica (dihidroxilación asimétrica de Sharpless).
El óxido de osmio (VIII) también se utiliza en cantidades catalíticas en la oxiaminación de Sharpless para dar aminoalcoholes vicinales.
En combinación con el periodato de sodio, el OsO4 se utiliza para la escisión oxidativa de alquenos (oxidación de Lemieux-Johnson) cuando el periodato sirve tanto para escindir el diol formado por la dihidroxilación, como para reoxidar el OsO3 de nuevo a OsO4. La transformación neta es idéntica a la producida por la ozonólisis.
Tinción biológica y de polimeros
El tetróxido de osmio es un agente de tinción muy utilizado en la microscopía electrónica de transmisión (TEM) para aportar contraste a la imagen. Como tinción lipídica, también es útil en la microscopía electrónica de barrido (SEM) como alternativa al recubrimiento por sputter. Incorpora un metal pesado directamente en las membranas celulares, creando una alta tasa de dispersión de electrones sin necesidad de recubrir la membrana con una capa de metal, que puede oscurecer los detalles de la membrana celular.
En la tinción de la membrana plasmática, el óxido de osmio (VIII) se une a las regiones de la cabeza de los fosfolípidos, creando así un contraste con el protoplasma vecino (citoplasma). Además, el óxido de osmio (VIII) también se utiliza para fijar muestras biológicas junto con HgCl2. Su capacidad de eliminación rápida se utiliza para matar rápidamente especímenes vivos, como los protozoos. El OsO4 estabiliza muchas proteínas transformándolas en geles sin destruir sus características estructurales. Las proteínas tisulares estabilizadas por el OsO4 no son coaguladas por los alcoholes durante la deshidratación. El óxido de osmio (VIII) también se utiliza como tinción de lípidos en microscopía óptica. El OsO4 también tiñe la córnea humana.
También se utiliza para teñir copolímeros de forma preferente, siendo el ejemplo más conocido los copolímeros en bloque en los que se puede teñir una fase para mostrar la microestructura del material. Por ejemplo, los copolímeros en bloque de estireno-butadieno tienen una cadena central de polibutadieno con tapas finales de poliestireno. Cuando se trata con OsO4, la matriz de butadieno reacciona preferentemente y así absorbe el óxido. La presencia de un metal pesado es suficiente para bloquear el haz de electrones, por lo que los dominios de poliestireno se ven claramente en películas finas en TEM.
Refinamiento del mineral de osmio
El tetroxido de osmio es un intermediario en la extracción del osmio de sus minerales. Los residuos que contienen osmio se tratan con peróxido de sodio (Na2O2) formando Na2[OsO4(OH)2], que es soluble. Cuando se expone al cloro, esta sal da OsO4. En las etapas finales del refinado, el OsO4 crudo se disuelve en NaOH alcohólico formando Na2[OsO2(OH)4], que, cuando se trata con NH4Cl, para dar (NH4)4[OsO2Cl2]. Esta sal se reduce bajo hidrógeno para dar osmio.
Toxicidad
El óxido de osmio (VII) es altamente venenoso. En particular, la inhalación a concentraciones muy por debajo de las que se puede percibir el olor puede provocar un edema pulmonar y la posterior muerte. Los síntomas perceptibles pueden tardar horas en aparecer tras la exposición.
El OsO4 mancha irreversiblemente la córnea humana, lo que puede provocar ceguera. El límite de exposición permitido para el óxido de osmio (VIII) (media ponderada en el tiempo de 8 horas) es de 2 µg/m3. El óxido de osmio (VIII) puede penetrar los plásticos y los envases de los alimentos, por lo que debe almacenarse en vidrio bajo refrigeración.
El 6 de abril de 2004, fuentes de la inteligencia británica creyeron haber frustrado un complot de simpatizantes de un grupo terrorista para detonar una bomba con OsO4. Los expertos entrevistados por New Scientist afirmaron la toxicidad del óxido de osmio (VIII), aunque algunos destacaron las dificultades de utilizarlo en un arma: el óxido de osmio (VIII) es muy caro, puede ser destruido por la explosión y los humos tóxicos restantes también pueden ser dispersados por la explosión.
Para más información Osmium tetroxide
Como citar este artículo:
APA: (2022-02-08). Tetróxido de osmio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/tetroxido-de-osmio/
ACS: . Tetróxido de osmio. https://quimicafacil.net/compuesto-de-la-semana/tetroxido-de-osmio/. Fecha de consulta 2024-04-20.
IEEE: , "Tetróxido de osmio," https://quimicafacil.net/compuesto-de-la-semana/tetroxido-de-osmio/, fecha de consulta 2024-04-20.
Vancouver: . Tetróxido de osmio. [Internet]. 2022-02-08 [citado 2024-04-20]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/tetroxido-de-osmio/.
MLA: . "Tetróxido de osmio." https://quimicafacil.net/compuesto-de-la-semana/tetroxido-de-osmio/. 2022-02-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net