Actualizado en mayo 22, 2023
Tiempo de lectura estimado: 8 minutos
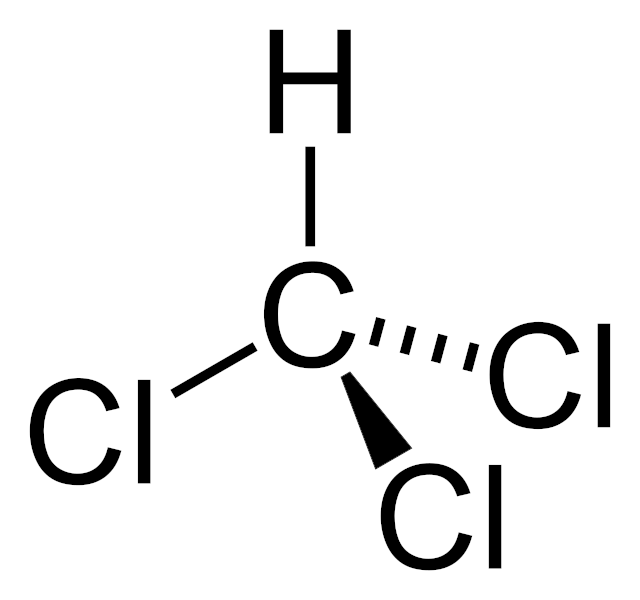
El cloroformo se llama formalmente triclorometano y posee la fórmula química CHCl3. Se trata de un líquido incoloro y de olor dulce que se convierte fácilmente en vapor. La molécula se llama tradicionalmente «cloroformo» debido a su similitud molecular con el ácido fórmico (CHOOH).
Aunque no es fácilmente inflamable, el cloroformo puede descomponerse formando productos nocivos como el cloruro de hidrógeno y el fosgeno. El primero se encuentra en el ácido clorhídrico, mientras que el segundo se utilizó ampliamente como gas letal.
Desde su descubrimiento ha tenido múltiples aplicaciones, principalmente como anestésico. Es uno de los cuatro clorometanos y un trihalometano. Es un potente anestésico, euforizante, ansiolítico y sedante cuando se inhala o se ingiere.
Historia
El cloroformo fue sintetizado de forma independiente por varios investigadores hacia 1831. Moldenhawer, un farmacéutico alemán de Frankfurt an der Oder, parece haber producido cloroformo en 1830 mezclando cal clorada con etanol; sin embargo, lo confundió con Cloräther (éter clórico, 1,2-dicloroetano).
Samuel Guthrie, un médico estadounidense de Sackets Harbor, Nueva York, también parece haber producido cloroformo en 1831 haciendo reaccionar cal clorada con etanol, además de constatar sus propiedades anestésicas; sin embargo, también creyó que había preparado éter clórico.
Justus von Liebig llevó a cabo la escisión alcalina del cloral. Eugène Soubeiran obtuvo el compuesto por la acción de la lejía de cloro sobre el etanol y la acetona.
En 1834, el químico francés Jean-Baptiste Dumas determinó la fórmula empírica del cloroformo y le dio un nombre. En 1835, Dumas preparó la sustancia por escisión alcalina del ácido tricloroacético. Regnault preparó el cloroformo por cloración del clorometano.
En 1842, Robert Mortimer Glover descubrió en Londres las cualidades anestésicas de este compuesto en animales de laboratorio. En 1847, el obstetra escocés James Y. Simpson fue el primero en demostrar las propiedades anestésicas del cloroformo en seres humanos, proporcionado por el farmacéutico local William Flockhart de Duncan, Flockhart and company, y ayudó a popularizar el fármaco para su uso en medicina.
En la década de 1850, el cloroformo se producía de forma comercial, en Gran Bretaña unas 750.000 dosis a la semana en 1895, mediante el procedimiento Liebig, que mantuvo su importancia hasta la década de 1960. En la actualidad, el cloroformo -junto con el diclorometano- se prepara exclusivamente y a gran escala mediante la cloración de metano y clorometano.
Cloroformo en el medio ambiente
El flujo global total de cloroformo en el medio ambiente es de aproximadamente 660000 toneladas al año, y cerca del 90% de las emisiones son de origen natural. Muchos tipos de algas producen cloroformo, y se cree que los hongos tambien producen en el suelo. También se cree que los procesos abióticos contribuyen a la producción natural de cloroformo en los suelos, aunque el mecanismo aún no está claro.
El cloroformo se volatiliza fácilmente del suelo y del agua superficial y se degrada en el aire para producir fosgeno, diclorometano, cloruro de formilo, monóxido de carbono, dióxido de carbono y cloruro de hidrógeno. Su vida media en el aire oscila entre 55 y 620 días. La biodegradación en el agua y el suelo es lenta. El cloroformo no se bioacumula significativamente en los organismos acuáticos.
Cloroformo deuterado
El cloroformo deuterado (CDCl3), también conocido como cloroformo-d, es una forma isotópica enriquecida del cloroformo en la que la mayoría de sus átomos de hidrógeno están formados por el núclido más pesado deuterio (hidrógeno pesado) (D = 2H) en lugar de la mezcla isotópica natural en la que predomina el protio (1H).
El cloroformo deuterado es, con mucho, el disolvente más utilizado en espectroscopia de RMN. [Mientras que el diclorometano y el cloroformo (triclorometano) son disolventes de uso común que disuelven una amplia gama de otros compuestos orgánicos, el cloroformo deuterado es más fácil de producir y mucho menos costoso que el diclorometano deuterado. Además, es químicamente poco reactivo y es poco probable que intercambie su deuterio con su soluto, y su bajo punto de ebullición permite una fácil recuperación de la muestra.
Las propiedades del CDCl3 son prácticamente idénticas a las del cloroformo normal, aunque biológicamente es ligeramente menos tóxico para el hígado que el CHCl3, debido a su enlace C-D, que es más fuerte que un enlace C-H, lo que lo hace algo menos propenso a formar el destructivo radical triclorometilo (-CCl3).
Uso como solvente de RMN
En la espectroscopia RMN de protones, debe utilizarse un disolvente deuterado (enriquecido hasta >99% de deuterio) para evitar el registro de una gran señal de interferencia o de señales procedentes del protón o protones (es decir, hidrógeno-1) presentes en el propio disolvente. Si se utilizara cloroformo no deuterado (que contiene un equivalente completo de protio) como disolvente, la señal del disolvente casi seguro que abrumaría y oscurecería cualquier señal del analito cercano.
Además, los instrumentos modernos suelen requerir la presencia de disolvente deuterado, ya que la frecuencia de campo se bloquea utilizando la señal de deuterio del disolvente para evitar la deriva de frecuencia. Sin embargo, el cloroformo-d comercial todavía contiene una pequeña cantidad (0,2% o menos) de cloroformo no deuterado; esto da lugar a un pequeño singlete a 7,26 ppm, conocido como pico de disolvente residual, que se utiliza frecuentemente como referencia de desplazamiento químico interno.
En la espectroscopia de RMN de carbono-13, el único carbono del cloroformo deuterado muestra un triplete con un desplazamiento químico de 77,16 ppm, con los tres picos de igual tamaño, resultante de la división por acoplamiento de espín con el átomo de deuterio de espín 1 unido (el CHCl3 tiene un desplazamiento químico de 77,36 ppm).
Reacciona fotoquímicamente con el oxígeno para formar fosgeno y cloruro de hidrógeno. Por lo tanto, deben utilizarse alternativas más caras como el diclorometano-d2 o el benceno-d6 si se espera que el analito sea muy sensible al ácido. Para ralentizar este proceso y reducir la acidez del disolvente, el cloroformo-d se almacena en botellas de color marrón, a menudo sobre virutas de cobre o papel de plata como estabilizador. En lugar de metales, puede añadirse una pequeña cantidad de una base neutralizadora como el carbonato de potasio.
Supuestos usos ilegales
El cloroformo ha sido supuestamente utilizado por los criminales para noquear, aturdir o incluso asesinar a sus víctimas. En 1894 se acusó a Joseph Harris de utilizar cloroformo para robar, el asesino en serie H. H. Holmes utilizaba sobredosis de cloroformo para matar a sus víctimas femeninas.
En septiembre de 1900, el cloroformo estuvo implicado en el asesinato del empresario estadounidense William Marsh Rice, que dio nombre a la institución que hoy se conoce como Universidad de Rice. El cloroformo se consideró un factor en el presunto asesinato de una mujer en 1991, cuando fue asfixiada mientras dormía.
En 2002, Kacie Woody, de 13 años, fue sedada con cloroformo cuando fue secuestrada por David Fuller y durante el tiempo que la tuvo, antes de dispararle y matarla. En un acuerdo de culpabilidad de 2007, un hombre confesó haber utilizado pistolas paralizantes y cloroformo para agredir sexualmente a menores.
El mito del cloroformo en la literatura y el cine
El uso del cloroformo como agente incapacitante ha llegado a ser ampliamente reconocido, rozando el cliché, debido a la popularidad de los autores de novelas policíacas que hacen que los criminales utilicen trapos empapados en cloroformo para dejar a las víctimas inconscientes. Sin embargo, es casi imposible incapacitar a alguien utilizando cloroformo de esta manera. Se necesitan al menos cinco minutos de inhalación de un artículo empapado en cloroformo para dejar a una persona inconsciente.
En la mayoría de los casos penales en los que se utiliza también se administra otra droga, como alcohol o diazepam, o se descubre que la víctima ha sido cómplice de su administración.
Después de que una persona haya perdido el conocimiento debido a la inhalación de cloroformo, hay que administrar un volumen continuo y sostener la barbilla para evitar que la lengua obstruya las vías respiratorias, un procedimiento difícil que suele requerir las habilidades de un anestesista.
En 1865, como resultado directo de la reputación criminal que había adquirido este compuesto, la revista médica The Lancet ofreció una «reputación científica permanente» a quien pudiera demostrar la «insensibilidad instantánea», es decir, perder el conocimiento instantáneamente, utilizando cloroformo.
Para más información Chloroform
Como citar este artículo:
APA: (2022-06-07). Cloroformo. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/cloroformo/
ACS: . Cloroformo. https://quimicafacil.net/compuesto-de-la-semana/cloroformo/. Fecha de consulta 2024-07-27.
IEEE: , "Cloroformo," https://quimicafacil.net/compuesto-de-la-semana/cloroformo/, fecha de consulta 2024-07-27.
Vancouver: . Cloroformo. [Internet]. 2022-06-07 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/cloroformo/.
MLA: . "Cloroformo." https://quimicafacil.net/compuesto-de-la-semana/cloroformo/. 2022-06-07. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net