Tiempo de lectura estimado: 4 minutos
El ácido acetilsalicílico, conocido comercialmente como aspirina, es uno de los medicamentos mas vendidos en el mundo, empleado para multitud de enfermedades y condiciones que van desde el dolor de cabeza, fiebre, dolor, hasta la enfermedad de Kawasaki, pericarditis y fiebre reumática.
La molécula precursora de la aspirina se encuentra de manera natural en el sauce, perteneciente al genero Salix, cuya corteza se ha empleado en medicina desde la antigüedad a través de su extracto llamado salicina.
En este extracto se identificó por primera vez el ácido salicílico por Henry Leroux y Raffaele Piria. El uso de ácido salicílico mejoraba síntomas asociados a la gripa y otras enfermedades, pero con el efecto secundario indeseable de malestar estomacal.
En 1897, Felix Hoffmann desarrollo un alternativo sintético con menor incidencia de este efecto secundario, y esta molécula, el ácido acetilsalicílico, recibió el nombre de aspirina por la empresa farmacéutica alemana Bayer AG e inicio su comercialización a nivel mundial. Actualmente, la patente sobre la producción de esta molécula ha expirado y puede ser producido libremente.
Ácido acetilsalicílico
La aspirina es aun actualmente, uno de los medicamentos mas vendidos en todo el mundo. De venta libre en casi todos los países, es recomendado para un amplio espectro de condiciones medicas que van desde fiebre, dolor de cabeza y cuerpo, inflamación hasta el control y prevención de enfermedades cardiacas.

Desde un punto de vista químico, la síntesis de aspirina es clasificada como una reacción de esterificación. El ácido salicílico se trata con anhidrido acético, atacando el grupo hidroxilo del acido y esterificándolo, teniendo como productos el ácido acetilsalicílico y ácido acético como subproducto.
El ácido acetilsalicílico se descompone rápidamente en soluciones de acetato de amonio, o en soluciones de acetatos, carbonatos, citratos o hidróxidos de metales alcalinos.
Es estable al ambiente, pero se descompone gradualmente en presencia de humedad generando acido acético y ácido salicílico. En la producción industrial de aspirina, se debe controlar la cantidad de polvo en el ambiente, ya que puede llegar a limites explosivos.
Materiales
- Balón de fondo redondo de dos bocas de 100 mL
- Pipeta graduada de 10 mL
- Pipeteador o propipeta
- Perlas de ebullición
- Vidrio de reloj
- Espátula
- Condensador de bolas o Allihn
- Plancha de calentamiento
- Soporte universal
- Pinzas
- Equipo de filtración al vacío
- Vaso de precipitados
- Baño de maría
- Termómetro
- Balanza analítica
- Papel de filtro
- Desecador
Reactivos
- Ácido salicílico
- Anhidrido acético
- Ácido sulfúrico concentrado
- Agua destilada
Procedimiento
Tiempo necesario: 1 hora
Síntesis de ácido acetilsalicílico
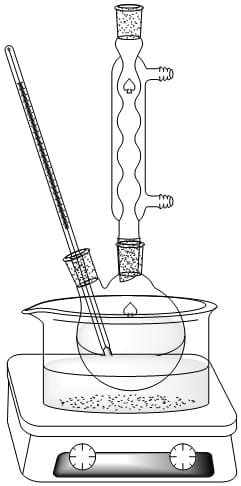
En el balón de fondo redondo colocar 2,5 g de ácido salicílico, 5 mL de anhídrido acético y 4 gotas de ácido sulfúrico concentrado. Colocar unas perlas de ebullición (o trozos de porcelana) y se arman un sistema de reacción como el indicado en la figura. Mantener el balón en un rango de temperatura de 60 – 70 °C por espacio de 10 minutos
 Anuncio
AnuncioInterrumpir el calentamiento y dejar enfriar. Observar la formación de un precipitado blanco.
Añadir 25 mL de agua fría y agitar el balón. Recoger los cristales empleando filtración al vacío y un papel filtro previamente tarado, dejar secar un poco empleando el vacío y posteriormente llevar a un desecador por 24 horas. Estimar la masa del producto obtenido y calcular el rendimiento de la reacción.
Si se desea caracterizar el producto a través de su punto de fusión, es aconsejable recristalizar una pequeña parte del producto empleando una mezcla 50:50 de etanol/agua calentada en un baño de María y emplear este producto purificado para el análisis.
Después del experimento
Escribir el mecanismo de la reacción empleada en el experimento.
Calcular el rendimiento de la reacción y determinar cual de los reactivos empleados es el limitante
Proponer una metodología de laboratorio para separar el ácido acetilsalicílico del acido salicílico restante en caso que este sea el reactivo en exceso.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales.
Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2019-08-14). Síntesis de ácido acetilsalicílico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-organica/sintesis-de-acido-acetilsalicilico/
ACS: . Síntesis de ácido acetilsalicílico. https://quimicafacil.net/manual-de-laboratorio/q-organica/sintesis-de-acido-acetilsalicilico/. Fecha de consulta 2026-02-15.
IEEE: , "Síntesis de ácido acetilsalicílico," https://quimicafacil.net/manual-de-laboratorio/q-organica/sintesis-de-acido-acetilsalicilico/, fecha de consulta 2026-02-15.
Vancouver: . Síntesis de ácido acetilsalicílico. [Internet]. 2019-08-14 [citado 2026-02-15]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-organica/sintesis-de-acido-acetilsalicilico/.
MLA: . "Síntesis de ácido acetilsalicílico." https://quimicafacil.net/manual-de-laboratorio/q-organica/sintesis-de-acido-acetilsalicilico/. 2019-08-14. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net