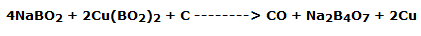Tiempo de lectura estimado: 7 minutos
La prueba de perlas es una parte tradicional del análisis inorgánico cualitativo para comprobar la presencia de ciertos metales. La más antigua es la prueba del cordón de bórax o prueba de la ampolla. Fue introducida por Berzelius en 1812. Desde entonces se utilizaron otras sales como agentes fundentes, como el carbonato de sodio o el fluoruro de sodio. La más importante después del bórax es la sal microcósmica, que es la base de la prueba de la perla de sal microcósmica.
¿Qué es una prueba de perlas o ensayo a la perla?
Se trata de un tipo de análisis en seco alternativo o complementario a las pruebas de llama. Se basa en la capacidad de algunas sales, entre ellas el tetraborato de sodio decahidratado (Na2B4O7 – 10H2O), comúnmente llamado bórax, y el fosfato de sodio y amonio (NaNH4HPO4 – 4H2O), llamado sal de fósforo, de fundirse y formar una masa vítrea incolora llamada perla.
Perla de bórax
El bórax llevado a la fusión sobre la llama del bunsen se hincha inicialmente y elimina el agua de cristalización:
entonces, de nuevo por calentamiento, el tetraborato de sodio anhidro libera anhídrido bórico (B2O3) y metaborato de sodio (NaBO2) según la siguiente reacción:
Trabajando con una llama oxidante, el óxido bórico es capaz de disolver los óxidos metálicos, posiblemente procedentes de la transformación, por la acción del calor, de otros compuestos, transformándolos en metaboratos que tienen colores característicos según el metal presente. La reacción es del tipo
En este caso es el metaborato de cobre (II) (verde-azul)
Operando con una llama reductora, preferiblemente en presencia de un poco de polvo de carbón, el metaborato puede reducirse dando una llama de diferente color:
Siendo el compuesto el metaborato de cobre (I) (verde pálido)
Al continuar el calentamiento en una llama reductora, se puede obtener una mayor reducción a cobre metálico, lo que hace que la perla sea de color rojo-marrón y opaca:
Perlas de sal de fósforo:
La sal de fósforo llevada a la fusión del bunsen pierde agua y amoníaco convirtiéndose en una perla de metafosfato de sodio:
Si el metafosfato de sodio entra en contacto con los óxidos metálicos en una llama oxidante, reacciona para formar los correspondientes ortofosfatos dobles que dan a la perla los colores característicos de cada metal. La reacción es del tipo
El compuesto resultante es el ortofosfato de sodio y cobalto
También en el caso de las sales de fósforo, la fusión a la llama reductora conduce, en algunos óxidos metálicos, a una reducción ulterior, con diferentes colores de la perla.
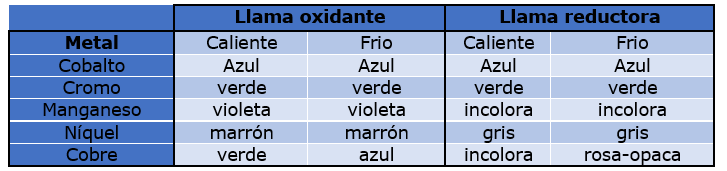
Para algunos metales la perla puede cambiar de color después de enfriarse, por lo que la tabla muestra los colores de algunos metales con llamas oxidantes y reductoras y con temperaturas calientes y frías.
Coloración obtenida a la perla de bórax
Coloración obtenida a la perla de sal de fósforo
Materiales
- Alambre de níquel-cromo
- Mechero Bunsen
- Pinzas metálicas
- Vidrio de reloj
- Placa de vidrio o pozos
Reactivos
- Tetraborato de sodio decahidratado
- Fosfato de amonio de sodio tetrahidratado
- Sales de cobalto, cromo, cobre, manganeso, níquel, hierro
- Sol de ácido clorhídrico. 37 %
Procedimiento
Primera parte: prueba de perlas de bórax:
El bórax se dispone en un vidrio de reloj y pequeñas muestras de las sales u óxidos se disponen en una placa de vidrio.
Los alambres de níquel-cromo de 3 o 4 cm de longitud se preparan montándolos en varillas de vidrio o sujetándolos con pinzas; los extremos distales de los alambres se doblan para formar pequeños bucles, se sumergen en ácido clorhídrico concentrado y se llevan a la llama del bunsen para limpiarlos.
Sumergimos el alambre limpio y al rojo vivo en el bórax y lo acercamos inmediatamente a la llama oxidante (manto externo); repetimos la operación varias veces hasta conseguir una perla vidriosa y transparente de 4 o 5 mm de diámetro.
En este punto tomamos con la perla unos cristales del primer óxido o de la primera sal examinada y la acercamos de nuevo a la llama; tras unos segundos de calentamiento, una vez que se ha producido la fusión y la reacción entre el anhídrido bórico y el compuesto, retiramos la perla y observamos el color cuando está caliente. Espere unos segundos y compruebe si el color cambia al enfriarse.
Proceder de la misma manera con todas las muestras que se examinen.
Si es necesario, se procederá a un análisis idéntico colocando la perla y la muestra bajo una llama reductora para observar las variaciones de color.
Nota: Es necesario cambiar el hilo de níquel-cromo y fabricar un nuevo cordón para cada muestra a analizar, con el fin de evitar la contaminación. Es importante tomar pocos cristales de la muestra, ya que un exceso daría lugar a una perla muy oscura y, por tanto, no reconocible.
Segunda parte: prueba de la perla de sal fosfórica:
Se realiza la misma operación que en la etapa anterior, simplemente sustituyendo el bórax por sal de fósforo.
Después del laboratorio
Consultar los espectros de emisión de cada uno de los metales empleados y explicar el porque algunos elementos emiten el mismo color cuando se trabaja con bórax o con sal de fosforo y otros no.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información borax bead test
Como citar este artículo:
APA: (2021-10-27). Prueba de perlas. Recuperado de https://quimicafacil.net/manual-de-laboratorio/prueba-de-perlas/
ACS: . Prueba de perlas. https://quimicafacil.net/manual-de-laboratorio/prueba-de-perlas/. Fecha de consulta 2026-02-13.
IEEE: , "Prueba de perlas," https://quimicafacil.net/manual-de-laboratorio/prueba-de-perlas/, fecha de consulta 2026-02-13.
Vancouver: . Prueba de perlas. [Internet]. 2021-10-27 [citado 2026-02-13]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/prueba-de-perlas/.
MLA: . "Prueba de perlas." https://quimicafacil.net/manual-de-laboratorio/prueba-de-perlas/. 2021-10-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net