Tiempo de lectura estimado: 10 minutos
Los aldehídos y cetonas son compuestos simples que contienen un grupo carbonilo en su estructura (un doble enlace carbono – oxigeno). La reactividad de estos dos tipos de compuesto es determinada por la posición del doble enlace con el oxígeno, siendo mayor la reactividad de los aldehídos en comparación a las cetonas.
El estudio de las reacciones y propiedades de aldehídos y cetonas es de suma importancia, pues permiten dilucidar la interacción entre el oxigeno y el carbono a través de un doble enlace en un compuesto orgánico. Igualmente, estos tipos de compuestos son de uso fundamental en industria e investigación como base o intermedio en la síntesis de moléculas de mayor complejidad.
Características de los aldehídos y cetonas
Los aldehídos y cetonas son clases de compuestos orgánicos en los cuales un carbono se encuentra unido a un oxígeno a través de un doble enlace. Si el carbono es terminal en su respectiva cadena, es un aldehído. Si el carbono unido al oxigeno se encuentra en medio de otros dos átomos de carbono, entonces se considera que es una cetona.
Las reacciones de separación e identificación se basan en la capacidad del doble enlace oxigeno – carbono de interactuar con otras especies químicas. Debido a la alta diferencia de electronegatividad entre el carbono y el oxígeno, los electrones del enlace tienden a acercarse al oxígeno, generando un momento dipolar en el enlace.
Reacciones para la identificación de aldehídos y cetonas
Para iniciar la identificación de aldehídos y cetonas, primero es necesario conocer si en la molécula existe un grupo carbonilo, posteriormente, si el ensayo es positivo, se puede identificar si el grupo carbonilo es terminal o no, para poder diferenciar entre aldehído y cetona y por ultimo se realizan algunos ensayos para conocer más sobre la estructura de la molécula de estudio.
Formación de fenilhidrazonas
La fenilhidracina (C6H5NH-NH2) es un derivado del amoniaco, forma con los aldehídos y cetonas derivados sólidos de color amarillos denominados fenilhidrazonas.
La reacción de aldehídos y cetonas con un derivado del amoniaco constituyen un tipo de reacción y eliminación y puede suceder con cualquier derivado de este, desde la hidracina en adelante, aunque la presencia de sustituyentes en la hidracina favorece la aparición de color en los productos, por esta razón se prefiere emplear 2,4 – dinitrofenilhidracina. Para que la reacción suceda debe estar en presencia de un medio acido y metanol, y la solución de 2,4 – dinitrofenilhidracina con ácido sulfúrico y metanol se le conoce como reactivo de Brady.
El esquema general de reacción entre una cetona y la 2,4 – dinitrofenilhidracina se muestra a continuación.
La formación de un precipitado naranja – rojo es un resultado positivo.
Algunas cetonas no generaran un precipitado, pero se observará la generación de una capa de aspecto aceitoso de color. Algunos alcoholes alilicos se oxidan a aldehídos en la reacción y pueden generar un falso positivo, además, si se ensayan alcoholes que no son purificados previamente, pueden contener aldehídos y cetonas que darán resultados positivos.
Reacciones de oxidación
Las reacciones de oxidación permiten diferenciar entre aldehídos y cetonas. Existen una gran cantidad de pruebas de oxidación, pero las más conocidas son los ensayos de Fehling, Benedict y Tollens.
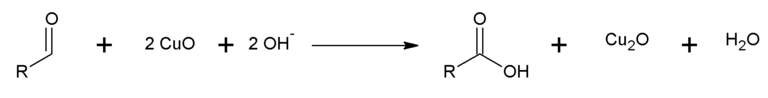
El ensayo de Fehling consiste en mezclar dos soluciones denominadas A y B en volúmenes iguales y adicionar una cantidad del compuesto a ensayar. Los aldehídos darán resultado positivo.
La solución A de Fehling consiste en una solución de sulfato de cobre (II), mientras que la solución B es una solución clara de tartrato de sodio y potasio (sal de Rochelle) en medio básico.
Mezclada ambas soluciones genera un complejo de bitartratocuprato (II), que es un agente oxidante que reacciona con el aldehído para generar un anión carboxilato, y en el proceso el Cu2+ pasa a cobre Cu+1 que precipita en forma de oxido de cobre (I) de color rojo.
La prueba de Fehling también se puede emplear como un ensayo genérico para la identificación de monosacáridos. El ensayo de Fehling genera un falso negativo cuando se ensayó un aldehído aromático, en cuyo caso es necesario realizar el ensayo de Tollens. También hay que tener en cuenta que sustancias como las α–hidroxicetonas dan resultados positivos y que los aldehídos aromáticos y alifáticos que no tengan un hidrogeno enlazado al carbono α no generaran precipitado.
El ensayo de Benedict consiste en un único reactivo que contiene sulfato de cobre, citrato de sodio y carbonato de sodio. Esta reduce a los aldehídos y puede usarse como prueba confirmatoria para estos. La reacción es semejante a la que se tiene en el ensayo de Fehling solo que el complejo orgánico es un citrato.
El ensayo de Tollens consiste en un reactivo que contiene un ion complejo de plata amoniacal, que se reduce a plata metálica cuando reacciona con aldehídos, azúcares y polihidroxifenoles fácilmente oxidables. En el ensayo se debe controlar el calentamiento ya que el exceso lleva a la oxidación de las cetonas siendo imposible su diferenciación.
Para preparar el reactivo de Tollens se debe mezclar 1 mL de hidróxido de sodio al 5% con 5 mL de nitrato de plata al 5%. Agitar y añadir gota a gota una solución de hidróxido de amonio 2N hasta disolver el precipitado.
Ensayo del yodoformo para metilcetonas
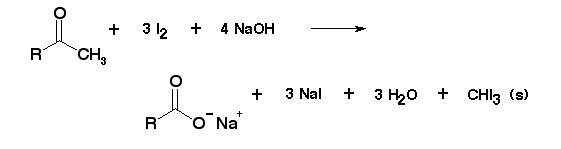
Cuando una cetona se encuentra cerca de uno de los extremos de la cadena carbonada, se genera la estructura llamada metilcetona (CH3CO) que puede ser detectada a través de un ensayo con un halogenuro, en general con yodo debido a su fácil identificación. Esta reacción también se puede emplear para la detección de la presencia de estructuras isopropílicas en alcoholes.
El ensayo basa en la capacidad de reaccionar del carbono alfa de la cetona en medio básico, que genera una sal y un haluro de metilo. A continuación, se muestra el esquema general de reacción.
El haluro de metilo puede ser fácilmente distinguible como un precipitado amarillo con olor característico, y se puede tomar su punto de fusión para confirmar la naturaleza del compuesto.
Materiales
- 20 tubos de Ensayo
- Gradilla
- Beaker o vaso de precipitados de 250 mL
- Pipeta de 10 mL
- Pinzas para tubo de ensayo
- Agitador de vidrio
- Vidrio de reloj
- Plancha de calentamiento
Reactivos
- Agua Destilada
- Ácido sulfúrico concentrado
- Reactivo de Brady
- Reactivos de Fehling A y B
- Reactivo de Benedict
- Reactivo de Tollens
- Solución de hidróxido de sodio 10%
- Reactivo de Lugol
- Muestras de 2 – 4 aldehídos y cetonas para ensayo según discreción del tutor
Análisis e identificación de aldehídos y cetonas
Formación de fenilhidrazonas
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver)
Adicionar a cada tubo 0,5 mL de reactivo de Brady (solución de 2,4 – dinitrofenilhidracina en metanol acidificado con acido sulfúrico), agitar fuertemente y registrar las observaciones por espacio de 10 minutos.
Reacciones de oxidación
Ensayo de Fehling
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver)
Añadir a cada tubo 0,5 mL de solución de Fehling A y 0,5mL de solución de Fehling B, agitar suavemente y colocar los tubos en un baño de agua hirviendo durante tres minutos. La aparición de un precipitado amarillo naranja es resultado positivo. Si se adiciono en exceso el reactivo puede aparecer una coloración verde que se toma también como positivo. El calentamiento no debe prolongarse pues las cetonas pueden oxidarse generando un falso positivo.
Ensayo de Benedict
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Adicionar 2 mL del reactivo de Benedict y calentar en un baño de agua hirviendo por tres minutos. Registrar las observaciones.
Ensayo de Tollens
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Adicionar 2 mL del reactivo de Tollens, agitar y dejar reposar por 10 minutos.
Si a los 10 minutos, no se observa reacción, calentar en baño maría a 35ºC por cinco minutos. Se debe controlar la temperatura para evitar la oxidación de cetonas. Registrar las observaciones. Un precipitado negro o espejo de plata en la superficie del tubo de ensayo es un resultado positivo.
Ensayo del yodoformo para metilcetonas
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Añadir 5 mL de dioxano y agitar hasta la disolución de la muestra.
Agregar 1 mL de hidróxido de sodio al 10% y solución de yodo – yoduro de potasio hasta mantener exceso de yodo (solución de Lugol), aparecerá una coloración oscura. Si hay decoloración con 2mL de la solución, colocar el tubo en un baño de agua caliente y controlar el ascenso de temperatura con un termómetro hasta 60ºC
Añadir más solución de Lugol hasta que se mantenga el color oscuro durante dos minutos a la temperatura indicada. Remover el exceso de yodo adicionando unas gotas de hidróxido de sodio al 10 % y agitar.
Llenar el tubo con agua y dejar en reposo por 15 minutos. Un precipitado amarillo indica la presencia de yodoformo (ensayo positivo).
Después del experimento
Para cada una de las sustancias ensayadas, escribir la reacción correspondiente en cada ensayo en caso de obtener un resultado positivo. En el caso de resultado negativo, explicar el porque no se da la reacción.
Plantear al menos tres casos de resultados falsos (positivo o negativo) para cada uno de los ensayos con sus respectivas reacciones y recomendaciones para identificar o evitar dichos resultados.
Recomendaciones de seguridad
Manejar con precaución los tubos de ensayo calentados al baño de maría con la ayuda de pinzas.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Tests for Aldehydes and Ketones
Como citar este artículo:
APA: (2019-02-06). Análisis e identificación de aldehídos y cetonas. Recuperado de https://quimicafacil.net/manual-de-laboratorio/identificacion-aldehidos-y-cetonas/
ACS: . Análisis e identificación de aldehídos y cetonas. https://quimicafacil.net/manual-de-laboratorio/identificacion-aldehidos-y-cetonas/. Fecha de consulta 2026-02-27.
IEEE: , "Análisis e identificación de aldehídos y cetonas," https://quimicafacil.net/manual-de-laboratorio/identificacion-aldehidos-y-cetonas/, fecha de consulta 2026-02-27.
Vancouver: . Análisis e identificación de aldehídos y cetonas. [Internet]. 2019-02-06 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/identificacion-aldehidos-y-cetonas/.
MLA: . "Análisis e identificación de aldehídos y cetonas." https://quimicafacil.net/manual-de-laboratorio/identificacion-aldehidos-y-cetonas/. 2019-02-06. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net