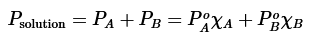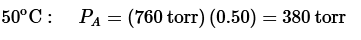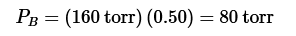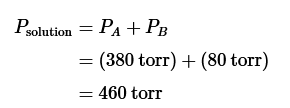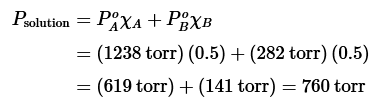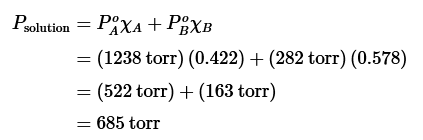Actualizado en enero 9, 2024
Tiempo de lectura estimado: 8 minutos
Las curvas de destilación ayudan a comprender el fenómeno de la destilación y ayudan a determinar las mejores condiciones para la separación
Curvas de destilación
La ecuación combinada de Raoult y Dalton describe el vapor producido por un sistema de dos componentes miscible (compuestos A + B). Esta ecuación matemática puede utilizarse para generar diagramas de fase, o curvas de destilación, que correlacionan gráficamente la temperatura con la composición molar de las fases líquida y vapor.
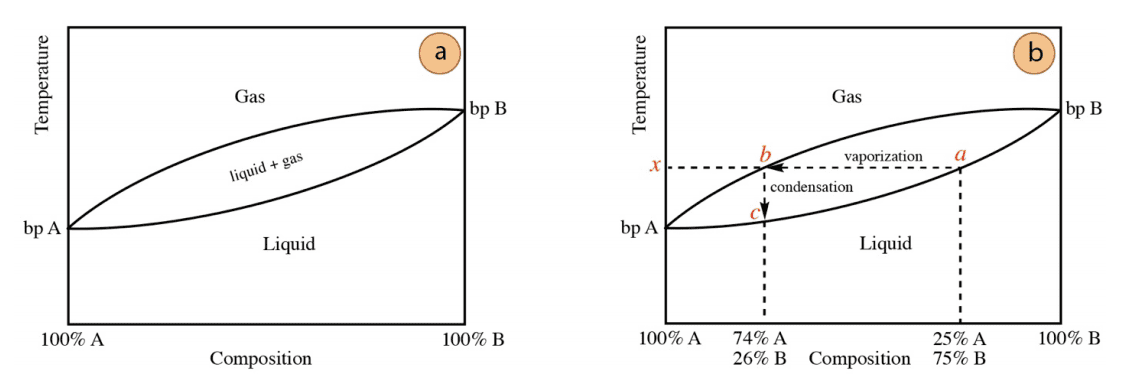
La siguiente figura muestra una curva de destilación genérica para un sistema de dos componentes. La composición molar se encuentra en el eje x, con el lado izquierdo del grafico correspondiente a una muestra del compuesto puro A y el lado derecho del grafico correspondiente a una muestra del compuesto puro B.
Entre ambos lados se representan las mezclas de A y B. La temperatura se encuentra en el eje y, y el punto de ebullición de cada compuesto está marcado (Punto de ebullición de A o «bp A» y Punto de ebullición de B o «bp B»).
En la destilación de mezclas, existe una diferencia de composición entre las fases líquida y gaseosa, lo que explica el aspecto lagrimal del diagrama de fases. La región en forma de lágrima representa las condiciones en las que coexisten el líquido y el gas, durante la ebullición del líquido.
Imagínese que se va a destilar una mezcla de 25% molar de A/75% molar de B, y esta mezcla se describe en la curva de destilación de la figura de arriba.
Cuando la temperatura alcanza la línea inferior del grafico (temperatura x y punto a en la figura), la solución comienza a hervir. Dado que el líquido y el gas tienen la misma temperatura durante la ebullición, se puede pensar que el proceso de vaporización sigue la línea horizontal desde la posición a hasta la b en la Figura.
Después de la vaporización, el gas se condensa en el destilado, lo que se puede representar a través de la línea vertical desde la posición b a la c en la Figura. En condiciones de equilibrio ideal, el destilado en este ejemplo sería 74% molar de A/26% molar de B, y está «enriquecido» en A ya que tiene el punto de ebullición más bajo y, por tanto, la presión de vapor más alta.
En una curva de destilación, el «movimiento» horizontal hacia la izquierda seguido de un «movimiento» vertical hacia abajo representa un evento de vaporización-condensación (véase la figura). Esto se denomina a menudo «plato teórico», terminología histórica relacionada con la recogida de destilado en platos o bandejas, y representa el potencial de purificación de una destilación simple.
Cada mezcla tiene su propia curva de destilación, que refleja los puntos de ebullición de los componentes.
Temperaturas de destilación
Un compuesto puro se destila a una temperatura constante, su punto de ebullición. Sin embargo, cuando se destilan mezclas, la temperatura no suele ser constante. Esta sección describe por qué las mezclas se destilan en un rango de temperaturas, y las temperaturas aproximadas a las que se espera que hiervan las soluciones. Estos conceptos pueden entenderse examinando la ecuación que describe la presión de vapor de una solución y las curvas de destilación.
Imagine una solución ideal que tenga cantidades equimolares de compuesto «A» (punto de ebullición = 50°C) y compuesto «B» (punto de ebullición = 100°C).
Un error común es pensar que esta solución entrara en ebullición a 50°C, en el punto de ebullición del compuesto más volátil. La solución no hierve en el punto de ebullición de A porque A tiene una presión parcial reducida cuando forma parte de una solución. De hecho, la presión parcial de A a 50°C sería la mitad de su presión de ebullición normal, como se muestra en la siguiente ecuación:
Dado que las presiones parciales de A y B son aditivas, la contribución de vapor de B a 50°C también es importante.
La presión parcial de B a 50°C sería igual a su presión de vapor a esta temperatura multiplicada por su fracción molar (0.50). Dado que B está por debajo de su punto de ebullición (100°C), su presión de vapor sería inferior a 760 torr, y el valor exacto tendría que ser consultado en literatura. Digamos que la presión de vapor de B a 50°C es de 160 torr.
La solución hierve cuando la presión combinada de los componentes es igual a la presión atmosférica (asumamos 760 torr para este cálculo). Por lo tanto, esta solución equimolar no herviría a 50°C, ya que su presión combinada es inferior a la presión externa de 760 torr.
El punto de ebullición inicial de esta solución es de 66°C, que es la temperatura en la que la presión combinada coincide con la presión atmosférica (todas las presiones de vapor tendrían que encontrarse en un libro de referencia). A 66°C repitiendo el cálculo anterior:
Estos cálculos demuestran que el punto de ebullición de una solución se produce a una temperatura entre los puntos de ebullición del componente.
Esto también puede observarse examinando la curva de destilación de este sistema, donde la solución hierve cuando la temperatura alcanza la posición a en la siguiente figura, una temperatura entre el punto de ebullición de los componentes.
Es importante tener en cuenta que las mezclas de compuestos orgánicos que contienen puntos de ebullición similares (Δ p.e. <100°C) pueden ebullir juntos. No actúan como entidades separadas.
La mezcla en este ejemplo comienza a hervir a 66°C, pero después de un período de tiempo la ebullición cesaría si se mantiene a esta temperatura.
Ejemplo de una curva de destilación
Esto sucede porque la composición del recipiente de destilación cambia con el tiempo. Dado que la destilación elimina la mayor parte del componente más volátil (A), el componente menos volátil B aumentará en porcentaje en el recipiente de destilación.
Imaginemos que después de destilar un poco de material, el recipiente de destilación tiene una concentración de 42.2% A y 57.8% B. Esta solución ya no ebulle a 66°C, como se muestra en la siguiente ecuación.
En la nueva composición de este ejemplo, la temperatura debe elevarse a 70 °C para mantener la ebullición.
Esto también puede demostrarse examinando la curva de destilación de la anterior figura, en la que la ebullición comienza a la temperatura c, pero debe elevarse a la temperatura e a medida que el recipiente de destilación se enriquece más en el componente de mayor ebullición (se desplaza hacia la derecha en la curva).
Estos cálculos y análisis de las curvas de destilación demuestran por qué una mezcla se destila en un rango de temperaturas a medida que la composición del recipiente de destilación cambia con el tiempo (lo que afecta a la fracción molar o al eje x de la curva de destilación), la temperatura debe ajustarse para compensar esta situación.
También muestra por qué un compuesto puro se destila a una temperatura constante: la fracción molar es la misma que la de un líquido puro, y la composición del recipiente de destilación permanece inalterada durante la destilación.
Los cálculos y curvas de destilación en esta sección permiten discutir otro aspecto de la destilación. Las presiones parciales de cada componente a las temperaturas de ebullición pueden correlacionarse directamente con la composición del destilado. Por lo tanto, el destilado a 66°C es 81% molar en A, mientras que el destilado a 70°C es 76% molar en A.
El destilado inicial contiene la mayor cantidad del componente de ebullición más baja, y el destilado se degrada en pureza a medida que avanza la destilación. Esto también puede verse en la curva de destilación de la figura, donde la composición inicial del destilado corresponde a la posición d (más pura), mientras que el destilado a 70°C corresponde a la posición f (menos pura).
Para más información Simple Distillation
Como citar este artículo:
APA: (2020-01-22). Destilación simple – curvas de destilación. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/curvas-de-destilacion/
ACS: . Destilación simple – curvas de destilación. https://quimicafacil.net/tecnicas-de-laboratorio/curvas-de-destilacion/. Fecha de consulta 2024-07-27.
IEEE: , "Destilación simple – curvas de destilación," https://quimicafacil.net/tecnicas-de-laboratorio/curvas-de-destilacion/, fecha de consulta 2024-07-27.
Vancouver: . Destilación simple – curvas de destilación. [Internet]. 2020-01-22 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/curvas-de-destilacion/.
MLA: . "Destilación simple – curvas de destilación." https://quimicafacil.net/tecnicas-de-laboratorio/curvas-de-destilacion/. 2020-01-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net