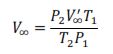Actualizado en enero 9, 2024
Tiempo de lectura estimado: 6 minutos
El peróxido de hidrógeno es un compuesto químico con la fórmula H2O2. En su forma pura, es un líquido azul muy pálido, ligeramente más viscoso que el agua. Se utiliza como oxidante, agente blanqueador y antiséptico, normalmente en forma de solución diluida (3-6% en peso) en agua para el consumo, y en concentraciones más altas para el uso industrial. El peróxido de hidrógeno concentrado, o «peróxido de alta resistencia», se descompone de forma explosiva cuando se calienta y se ha utilizado como propulsor en cohetería.
El objeto de estudio de esta práctica de laboratorio es la reacción de descomposición catalítica del peróxido de hidrógeno
Dado que en esta reacción se desprende oxígeno, el método que se utiliza para seguir su desarrollo es la medición del gas generado en la reacción, el cual permite determinar el volumen de O2 desprendido mediante la medición del volumen de agua desplazado en una bureta que está conectada a un recipiente con agua para mantener la presión del sistema constante. Se utiliza agua para no introducir impurezas, ya que esta es otro producto de la descomposición.
Determinación del volumen final del gas
Como el volumen de cualquier gas depende de la temperatura y de la presión, es necesario que el volumen final de oxígeno desprendido (V’∞) esté en las condiciones de la experiencia, para ello se considera que el gas se comporta de manera ideal:
Donde P1, T1 y V∞ son la presión atmosférica, la temperatura ambiente y el volumen final de oxígeno en las condiciones ideales y P2, T2 y V’∞ son las magnitudes medidas en el laboratorio. Por lo tanto, es necesario despejar V∞ para conocer el volumen del gas en condiciones ideales.
Materiales
- Probeta de 250 mL
- Erlenmeyer con desprendimiento lateral de 250 mL
- Tina neumática o recipiente hondo
- Pipeta volumétrica de 10 mL
- Balanza analítica
- Tubo de goma
- Cronometro
- Tapón de goma
Reactivos
- Solución de peróxido de hidrogeno al 1% fresca
- Dióxido de manganeso
Procedimiento
Realizar el siguiente montaje
Para llenar el montaje primero se debe llenar la probeta y tapar la boca de la probeta con la mano e introducir la probeta en la tina o recipiente con agua. Luego se introduce uno de los extremos de la manguera de goma.
Pesar alrededor de 1 mg de dióxido de manganeso en una balanza analítica.
Añadir el dióxido de manganeso (catalizador) en el Erlenmeyer con desprendimiento lateral y agitar la solución.
Dejar la solución reaccionar por espacio de 5 minutos para que la cinética de reacción se estabilice. Si se esta trabajando con un Erlenmeyer con desprendimiento lateral se puede tapar la boca con un tapón de goma y dejar escapar el gas producido por el brazo y si se esta trabajando con un Erlenmeyer tradicional se puede dejar el recipiente sin tapar.
Pasado el tiempo conectar el otro extremo de la manguera al desprendimiento del Erlenmeyer y poner en marcha el cronometro.
Realizar las lecturas en la probeta cada 2 o 3 minutos hasta obtener 10-15 lecturas. Anotar el nivel del agua. Anotar la temperatura y la presión del laboratorio.
Dejar el montaje de reacción 24 horas y anotar los valores finales de reacción.
Después del laboratorio
Determinación de la k de reacción
En esta práctica de laboratorio de cinética el catalizador utilizado es el dióxido de manganeso. El mecanismo de reacción es complejo y tiene un cinética de primer orden. Así la expresión para la velocidad de reacción es la siguiente
Integrando y despejando para k
En la descomposición del peróxido de hidrogeno se forma oxígeno gaseoso. El aumento de volumen es directamente proporcional a la concentración de H2O2 que ha reaccionado, asumiendo que la estequiometría de la ecuación global se mantiene durante toda la reacción. De esta forma se puede emplear el volumen de oxígeno para aplicar el método de la propiedad física.
Ajustando la ecuación anterior a los datos recolectados queda
Donde
K es la constante de velocidad especifica
V∞ es el volumen de oxígeno recolectado al final de la reacción
V0 es el volumen inicial del oxígeno
Vt es el volumen de oxígeno a un tiempo t dado
Si no se tiene un volumen inicial de oxígeno la expresión se reduce a
Esta ecuación se puede emplear para calcular la constante de velocidad específica de forma analítica. El valor de también se puede hallar gráficamente. En este caso la ecuación se reordena de la siguiente forma:
Así, el gráfico de log(V∞ – Vt) vs. t es una recta de pendiente – k/2.303 y la intersección con el eje de las ordenadas es logV∞. Del valor de la pendiente se calcula la magnitud de la constante cinética.
Para más información Decomposition of H₂O₂ with MnO₂
Como citar este artículo:
APA: (2022-05-11). Descomposición catalítica del peróxido de hidrógeno. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/descomposicion-catalitica-del-peroxido-de-hidrogeno/
ACS: . Descomposición catalítica del peróxido de hidrógeno. https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/descomposicion-catalitica-del-peroxido-de-hidrogeno/. Fecha de consulta 2024-07-27.
IEEE: , "Descomposición catalítica del peróxido de hidrógeno," https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/descomposicion-catalitica-del-peroxido-de-hidrogeno/, fecha de consulta 2024-07-27.
Vancouver: . Descomposición catalítica del peróxido de hidrógeno. [Internet]. 2022-05-11 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/descomposicion-catalitica-del-peroxido-de-hidrogeno/.
MLA: . "Descomposición catalítica del peróxido de hidrógeno." https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/descomposicion-catalitica-del-peroxido-de-hidrogeno/. 2022-05-11. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net