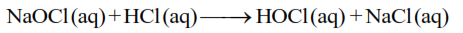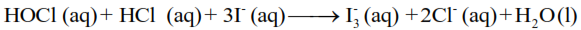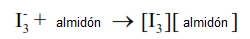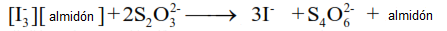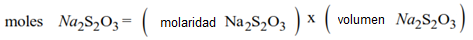Tiempo de lectura estimado: 10 minutos
Blanqueador es el nombre genérico de cualquier producto químico que se utiliza industrial o domésticamente para eliminar el color de un tejido o fibra o para limpiar o eliminar las manchas en un proceso llamado blanqueo. A menudo se refiere, específicamente, a una solución diluida de hipoclorito de sodio, también llamada «lejía líquida».
Muchas lejías tienen propiedades bactericidas de amplio espectro, lo que las hace útiles para desinfectar y esterilizar y se utilizan en el saneamiento de piscinas para controlar las bacterias, los virus y las algas y en muchos lugares donde se requieren condiciones de esterilidad. También se utilizan en muchos procesos industriales, sobre todo en el blanqueo de la pasta de madera. Las lejías también tienen otros usos menores, como eliminar el moho, matar las malas hierbas y aumentar la longevidad de las flores cortadas.
Las lejías reaccionan con muchos compuestos orgánicos coloreados, como los pigmentos naturales, y los convierten en incoloros. Aunque la mayoría de los blanqueadores son agentes oxidantes (sustancias químicas que pueden eliminar electrones de otras moléculas), algunos son agentes reductores (que donan electrones).
El cloro, un potente oxidante, es el agente activo de muchos blanqueadores domésticos. Como el cloro puro es un gas corrosivo tóxico, estos productos suelen contener hipoclorito, que libera cloro.
Los agentes blanqueadores oxidantes que no contienen cloro suelen basarse en peróxidos como el peróxido de hidrógeno, el percarbonato de sodio y el perborato de sodio. Estos blanqueadores se denominan «blanqueadores sin cloro», «blanqueadores con oxígeno» o «blanqueadores seguros para el color».
Determinación de hipoclorito en un blanqueador
Estudiaremos un ejemplo de valoración redox para determinar la concentración de hipoclorito de sodio de hipoclorito de sodio, el ingrediente activo de la lejía comercial.
Una solución acuosa de hipoclorito de sodio (NaOCl) es un líquido ligeramente amarillo, y se conoce comúnmente como lejía. Aparte de sus usos como agente blanqueador, las soluciones de hipoclorito de sodio también se utilizan como agentes esterilizadores y en el tratamiento del agua. Los usos industriales incluyen la agricultura, la alimentación, la producción de papel y los textiles. El hipoclorito de sodio también se añade a las aguas residuales para reducir los olores.
La concentración de hipoclorito de sodio en las soluciones de lejía puede determinarse por titulación. Un método deseable sería encontrar un valorante que reaccione con el NaOCl para formar un producto coloreado. Pero no existen sistemas simples de titulación colorimétrica que funcionen bien. Por lo tanto, debemos utilizar un método de varios pasos para valorar el hipoclorito de sodio.
En el primer paso se combinan el hipoclorito de sodio, el ácido clorhídrico, el ion yoduro y el almidón para formar un complejo complejo almidón-trioduro. En este paso tienen lugar tres reacciones:
El ácido clorhídrico reacciona con el hipoclorito de sodio para formar ácido hipocloroso:
El ácido hipocloroso reacciona con el yoduro cuando la solución es ácida:
Tridioduro, I3– es un complejo de color rojo oscuro. Se forma un complejo azul oscuro cuando el triyoduro se combina con almidón.
El resultado de estas tres reacciones es que cuando hay hipoclorito de sodio se produce el complejo almidón-trioduro. Esto es útil porque el resultado de estas tres reacciones es la formación de un complejo azul oscuro que tiene una concentración que es proporcional a la cantidad de hipoclorito de sodio en la solución.
En el siguiente paso, el producto almidón-triioduro se valora con tiosulfato de sodio para formar una solución incolora de yoduro, ditionato y almidón no complejado:
Si se añade yoduro en exceso al ácido hipocloroso, todo el ácido hipocloroso reaccionará, formando el complejo azul oscuro de almidón y triyoduro. El hipoclorito actúa como reactivo limitante, determinando la cantidad de triyoduro que se produce. A continuación, se puede valorar el complejo triyoduro-almidón con el tiosulfato para determinar la concentración del complejo formado. Esto puede utilizarse para calcular la concentración inicial de hipoclorito.
Materiales y equipos
- Bureta de 50,00 mL
- Balón o matraz aforado de 250 mL
- pipeta aforada de 25,00 mL
- Propipeta o pipeteador
- Erlenmeyer de 200 mL o 300 mL
- probeta graduada de 10 mL
- probeta graduada de 100 mL
- vaso de precipitados de 100 mL
Reactivos
- Solución comercial de lejía o blanqueador de hogar (hipoclorito al 4-6%)
- Solución de yoduro de potasio (KI) al 10%
- Solución de ácido clorhídrico (HCl) 2.0 m
- Solución de tiosulfato de sodio 0,26 m (na2s2o3)
- Solución de almidón
Procedimiento
Preparación de la bureta con tiosulfato
Obtener unos 60 mL de solución de tiosulfato de sodio utilizando un vaso de precipitados de 100 mL limpio y seco. Registrar la concentración de esta solución en la Hoja de Datos.
Enjuague una bureta de 50 mL con agua del grifo y luego con agua destilada o desionizada. Enjuagar la bureta con algunos mililitros de la solución de tiosulfato de sodio.
Llenar la bureta hasta justo por encima de la marca de 0 mL con solución de tiosulfato de sodio. Deje que algunos mililitros pasen a través de la punta de la bureta para que el aire atrapado pueda ser expulsado. Lea y registre el nivel inicial de la bureta con una precisión de 0,05 mL.
Dilución de hipoclorito de sodio
Realice una dilución cuantitativa de la lejía de 10 veces. Utilizar una pipeta volumétrica limpia de 25 mL para introducir 25,00 mL de solución de lejía en un matraz volumétrico limpio de 250 mL. Añade agua destilada o desionizada hasta la marca del matraz aforado. Asegúrese de mezclar bien la solución para que sea homogénea.
La lejía debe tener ahora una décima parte de su concentración original y puede utilizarse en sus valoraciones. Enjuaga la pipeta con agua destilada o desionizada para eliminar la solución de lejía.
Valoración de la lejía
La valoración se realiza en un matraz Erlenmeyer grande. Utilizando la pipeta volumétrica de 25 mL, añada cuidadosamente 25,00 mL de lejía diluida al Erlenmeyer.
Con una probeta graduada de 100 mL, añade unos 15 mL de agua destilada o desionizada al matraz de reacción.
Con una probeta graduada de 100 mL, añade unos 20 mL de solución de yoduro de potasio al 10% al matraz de reacción.
Vierte unos 2 mL de solución de almidón en una probeta graduada de 10 mL. Esta solución de almidón se añadirá más tarde al Erlenmeyer.
Con una probeta graduada de 100 mL, añade unos 20 mL de solución de ácido clorhídrico al matraz de reacción. Comienza la valoración inmediatamente después de añadir esta solución a la mezcla.
Comience a valorar la solución de lejía con la solución de tiosulfato de sodio. Añada la solución de tiosulfato al matraz Erlenmeyer, mientras agita hasta que la solución en el matraz adquiera un color amarillo pálido. Asegúrese de no añadir tanta cantidad como para que la solución se vuelva transparente. Lo que se busca es un color amarillo pálido. Una vez que la solución adquiera un color amarillo pálido, prepara la solución de almidón. No anote el volumen en la bureta en este momento; en unos momentos añadirá más solución de tiosulfato. Puede haber un precipitado oscuro de cristales de yodo sólido si se tarda en llegar a esta etapa.
Añade los 2 mL de solución de almidón de la probeta graduada al matraz Erlenmeyer. El color de la solución debe ser ahora azul oscuro.
Continúe la valoración gota a gota (esto significa una gota a la vez, lentamente) con agitación constante hasta que la solución se vuelva clara. Esta solución clara señala el punto final de la valoración. Registre el nivel de volumen de la bureta en la hoja de datos con una precisión de 0,05 mL. El contenido del Erlenmeyer debe verterse en el contenedor de residuos adecuado.
Realiza dos valoraciones más repitiendo los pasos desde la dilución del hipoclorito.
La densidad de la solución de lejía debe ser medida o buscada en literatura.
Una vez completada la valoración final, vierta los reactivos no utilizados en el contenedor de residuos correspondiente. La bureta debe enjuagarse con agua destilada o desionizada.
Después del laboratorio
Para calcular la molaridad de la solución de hipoclorito de sodio utilizamos el volumen de valoración, la molaridad del valorante de tiosulfato, la estequiometría de las reacciones y el volumen de la muestra de solución de lejía diluida.
Calcula el número de moles de valorante (tiosulfato de sodio) para cada valoración:
Los moles de hipoclorito se encuentran a partir de la estequiometría de la reacción con el tiosulfato. La estequiometría de la ecuación muestra que hay dos moles de ion tiosulfato por cada mol de ácido hipocloroso. Nótese que los moles de HOCl son iguales a los moles de NaOCl y OCl–.
La solución de lejía que hemos valorado estaba diluida por un factor de 10. Multiplica los moles del ácido hipocloroso por 10 para tener en cuenta este factor. Esto dará el número de moles de HOCl en 25,00 mL de lejía sin diluir.
El hipoclorito de sodio (NaOCl) es la forma del hipoclorito que se indica en las botellas de lejía, no el ácido hipocloroso. El porcentaje de masa de hipoclorito de sodio se encuentra a partir de la masa de hipoclorito de sodio en 25,00 mL y la masa de la solución de lejía de 25,00:
La masa del NaOCl se halla a partir de los moles de NaOCl y la masa molar del NaOCl:
La masa de 25,00 mL de solución de lejía se halla a partir de su densidad y del volumen (25,00 mL):
Realiza una prueba Q de Dixon con sus valores de porcentaje de masa y calcula una concentración media de porcentaje de masa. ¿Qué tan cerca está su resultado del valor indicado en la botella?
Para más información Bleach (sodium hypochlorite): a laboratory experiment relating to the daily teaching of chemistry
Como citar este artículo:
APA: (2022-09-07). Determinacion de hipoclorito en blanqueador. Recuperado de https://quimicafacil.net/manual-de-laboratorio/quimica-analitica/determinacion-de-hipoclorito-en-blanqueador/
ACS: . Determinacion de hipoclorito en blanqueador. https://quimicafacil.net/manual-de-laboratorio/quimica-analitica/determinacion-de-hipoclorito-en-blanqueador/. Fecha de consulta 2024-07-27.
IEEE: , "Determinacion de hipoclorito en blanqueador," https://quimicafacil.net/manual-de-laboratorio/quimica-analitica/determinacion-de-hipoclorito-en-blanqueador/, fecha de consulta 2024-07-27.
Vancouver: . Determinacion de hipoclorito en blanqueador. [Internet]. 2022-09-07 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/quimica-analitica/determinacion-de-hipoclorito-en-blanqueador/.
MLA: . "Determinacion de hipoclorito en blanqueador." https://quimicafacil.net/manual-de-laboratorio/quimica-analitica/determinacion-de-hipoclorito-en-blanqueador/. 2022-09-07. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net