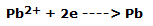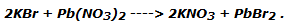Actualizado en mayo 22, 2023
Tiempo de lectura estimado: 5 minutos
La electrolisis de una sal fundida es una técnica que sirve para el aislamiento y purificación de algunos elementos que no se pueden obtener por otros métodos como el aluminio.
Un ejemplo clásico fue el aislamiento del sodio metálico por Sir Humphry Davy en 1807 a partir de hidróxido de sodio fundido. Si bien el hidróxido no es una sal, esto facilitó el aislamiento del sodio ya que en caso de utilizar una sal como el cloruro de sodio el punto de fusión a alcanzar hubiera sido más alto (el punto de fusión del hidróxido de sodio es 318 °C, mientras que el del cloruro de sodio es superior a 800 °C).
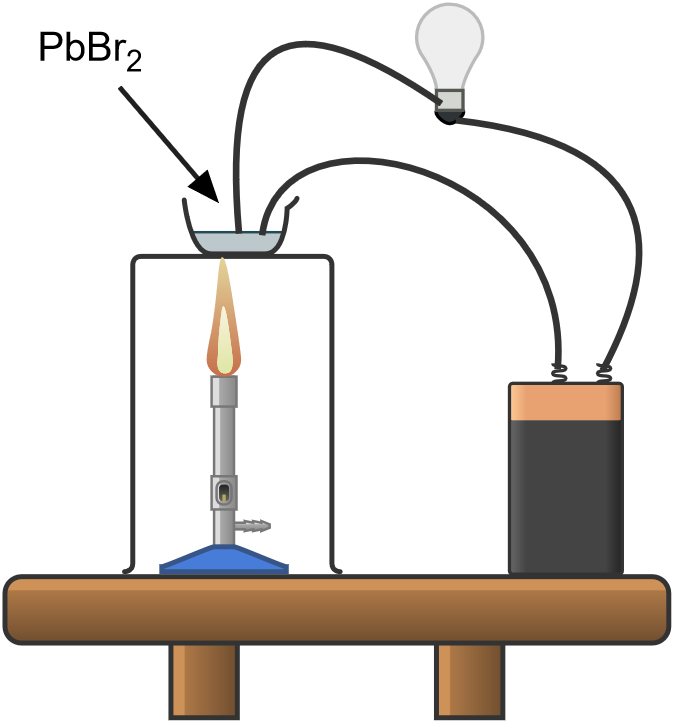
Se forman nuevas sustancias cuando un compuesto iónico fundido o disuelto conduce la electricidad. Por ejemplo, el bromuro de plomo puede utilizarse para producir bromo y plomo mediante el siguiente proceso
- colocar bromuro de plomo (II) sólido en un crisol y calentar sobre un mechero Bunsen hasta que se funda
- introducir dos electrodos de carbono en el electrolito fundido y hacer pasar una corriente continua entre ellos
Los electrodos de carbono se eligen porque tienen un punto de fusión elevado y son inertes (no reaccionan con los reactivos y productos durante la electrólisis).
Es fácil predecir los productos de la electrólisis de los electrolitos fundidos porque simplemente se dividen en sus elementos:
- el metal se forma en el electrodo negativo porque es donde se atraen los iones metálicos positivos
- el elemento no metálico se forma en el electrodo positivo, donde son atraídos los iones no metálicos negativos
Materiales
- Generador de corriente continua de 6 voltios
- Bombilla de 6 voltios
- Cables
- Electrodos de grafito
- Cápsula de porcelana
- Mechero Bunsen.
Reactivos
- Bromuro de potasio
Procedimiento – Electrólisis de una sal fundida
Se prepara un circuito eléctrico entre el generador de corriente continua y la bombilla; el circuito está abierto en un punto y los cables están conectados a dos electrodos de grafito. Conectando los electrodos directamente o colocando un conductor entre ellos, la bombilla se encenderá.
Se colocan 2 ó 3 gramos de bromuro de plomo en la cápsula de porcelana y se sumergen en sal las puntas de los electrodos montados en un soporte aislado y protegido por una lámina de mica o amianto. Como se ha visto en el experimento «Conductividad eléctrica», la bombilla no se enciende, ya que es una sustancia iónica cristalina.
En una campana de extracción de gases, colocar la cápsula con la sal y los electrodos en un trípode con una rejilla de amianto o placa conductora; colocar el mechero bunsen por debajo y encender.
Cuando la sal alcanza su punto de fusión (373 °C) la bombilla se enciende para indicar el cierre del circuito y el inicio del proceso electrolítico.
En el ánodo (+) podemos observar, después de unos segundos, el desarrollo de vapores rojizos de bromo elemental, debido a la reacción de oxidación:
En el cátodo ( – ) se produce la reducción de Pb2+ a plomo elemental, según la reacción:
Esto se hará evidente, al cerrar el bunsen y dejar que el sistema se enfríe, en forma de una bolita de metal que se deposita en el electrodo.
Notas sobre el laboratorio
Nota operativa: El bromuro de plomo no está disponible comercialmente. Por lo tanto, se puede producir por precipitación mediante la reacción del bromuro de potasio con el nitrato de plomo, según la reacción:
El precipitado así obtenido debe ser cuidadosamente filtrado, lavado y secado.
Nota. El presente experimento tiene un nivel de riesgo medio y debe ser usado en cursos superiores de química. También puede ser empleado como demostración para estudiantes con menor experiencia o habilidad de laboratorio.
Una posibilidad para mejorar el montaje de laboratorio es cambiar el mechero Bunsen por una placa o plancha de calentamiento que permita alcanzar la temperatura de fusión de la sal de trabajo.
Después del laboratorio
Investigar que otras sales fundidas pueden ser empleadas como conductores. ¿las sales fundidas son buenos o malos conductores? ¿cómo se podría determinar?
¿Qué uso industrial tienen las sales fundidas?
Para más información Electrolysis of Molten Salts and Electrolysis of Brine
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-06-23). Electrólisis de una sal fundida. Recuperado de https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-sal-fundida/
ACS: . Electrólisis de una sal fundida. https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-sal-fundida/. Fecha de consulta 2024-07-27.
IEEE: , "Electrólisis de una sal fundida," https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-sal-fundida/, fecha de consulta 2024-07-27.
Vancouver: . Electrólisis de una sal fundida. [Internet]. 2021-06-23 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-sal-fundida/.
MLA: . "Electrólisis de una sal fundida." https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-sal-fundida/. 2021-06-23. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net