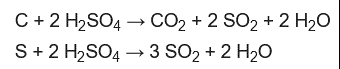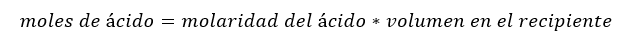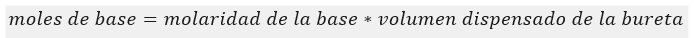Tiempo de lectura estimado: 10 minutos
El método Kjeldahl o digestión Kjeldahl en química analítica es un método para la determinación cuantitativa del nitrógeno contenido en las sustancias orgánicas más el nitrógeno contenido en los compuestos inorgánicos amoníaco y amonio (NH3/NH4+).
Sin modificación a la técnica, otras formas de nitrógeno inorgánico, por ejemplo, el nitrato, no se incluyen en esta medición. El uso de una relación empírica entre el contenido de nitrógeno Kjeldahl y el contenido de proteínas es un método importante para analizar las proteínas. Este método fue desarrollado por Johan Kjeldahl en 1883.
Un poco de historia del método Kjeldahl
En 1883, Johan Kjeldahl ideó un método para la determinación del nitrógeno, que se ha convertido en una medida clásica de la química analítica y se ha utilizado ampliamente durante los últimos 130 años.
En el método original, se utilizaba únicamente ácido sulfúrico como medio de digestión. El uso de un catalizador en la digestión Kjeldahl acelera la oxidación y completa la digestión para permitir la posterior determinación del nitrógeno. Los catalizadores preferidos son el mercurio (cuyo uso está en declive debido a la preocupación por el medio ambiente), el selenio y el cobre, aunque para ciertas aplicaciones se ha utilizado el titanio.
Pueden conseguirse tiempos de digestión cortos, asociados a una máxima recuperación de nitrógeno, utilizando una metodología basada en el diseño experimental y las superficies de respuesta, con procesos de digestión por microondas, y con la ayuda de la pareja ácido sulfúrico-peróxido de hidrógeno sin catalizador.
La cuantificación del amoníaco destilado se consigue generalmente por valoración; el amoníaco se absorbe en un exceso de ácido bórico, seguido de una valoración con ácido estándar en presencia de un indicador adecuado.
El método Kjeldahl puede realizarse con recursos limitados; la determinación del nitrógeno con el método Kjeldahl no requiere dispositivos caros ni técnicas especializadas y es precisa y exacta. El este método de análisis se utiliza para calibrar otros ensayos de proteínas; todavía hoy es el principal método de referencia para el análisis de proteínas.
El método original se ha mejorado de manera continua. Los sistemas de digestión actuales ofrecen seguridad tanto desde el punto de vista personal como medioambiental. La determinación del contenido de nitrógeno es un análisis que se realiza con frecuencia en la industria y el comercio, y numerosas organizaciones disponen de métodos oficiales.
Fundamento químico
El nitrógeno es uno de los cinco elementos principales que se encuentran en materiales orgánicos como las proteínas. Este hecho fue reconocido por un químico danés, Johan Kjeldahl, que lo utilizó como método para determinar la cantidad de proteínas en muestras tomadas de una gran variedad de organismos. En 1883, Kjeldahl presentó a la Sociedad Química Danesa un método (muy revisado desde su época) para determinar la cantidad de nitrógeno en mezclas de sustancias que contienen sales de amonio, nitrato o compuestos orgánicos de nitrógeno.
La base central utilizada en este procedimiento es la oxidación del compuesto orgánico utilizando ácido sulfúrico fuerte. A medida que el material orgánico se oxida, el carbono que contiene se convierte en dióxido de carbono y el hidrógeno se convierte en agua.
El nitrógeno, procedente de los grupos aminos que se encuentran en los enlaces peptídicos de las cadenas polipeptídicas, se convierte en iones de amonio, que se disuelven en la solución oxidante, y posteriormente pueden convertirse en gas amoníaco.
El método Kjeldahl de análisis de nitrógeno es el estándar mundial para calcular el contenido de proteínas en una amplia variedad de materiales que van desde la alimentación humana y animal, los fertilizantes, las aguas residuales y los combustibles fósiles.
El método consiste en calentar una muestra a 360-410 °C con ácido sulfúrico concentrado (H2SO4), que descompone («digiere» o «destruye») la muestra orgánica por oxidación para liberar el nitrógeno reducido como sulfato de amonio.
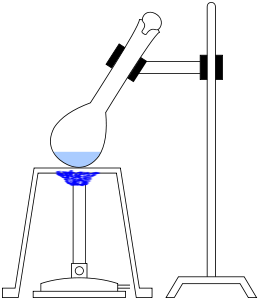
A menudo se añaden catalizadores como el selenio, el Hg2SO4 o el CuSO4 para que la digestión sea más rápida. También se añade Na2SO4 o K2SO4 para aumentar el punto de ebullición del H2SO4. La digestión se completa cuando el licor se clarifica con la liberación de humos. Se construye un sistema de destilación como el que se muestra a continuación.
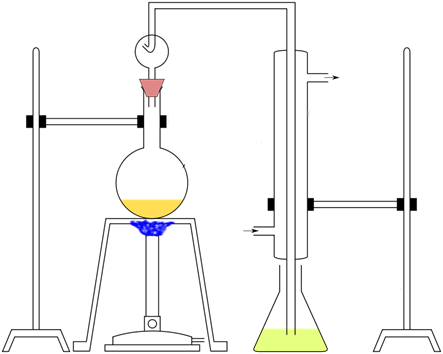
Las tres etapas del método Kjeldahl
El método Kjeldahl consta de tres pasos generales, que deben realizarse cuidadosamente en secuencia, aunque los detalles de cada paso pueden variar según la revisión del método que se escoja:
- la muestra se digiere primero en ácido sulfúrico fuerte en presencia de un catalizador, que ayuda a la conversión del nitrógeno amínico en iones de amonio,
- a continuación, los iones de amonio se convierten en gas amoníaco, se calientan y se destilan. El gas amoníaco es conducido a una solución de atrapamiento donde se disuelve y se convierte de nuevo en ion amonio,
- por último, se determina la cantidad de amoníaco que ha quedado atrapada mediante una valoración con una solución patrón, y se realiza un cálculo.
Digestión
Este es el paso que más tiempo consume en el análisis. El objetivo de este paso es romper los enlaces que mantienen unidos a los polipéptidos y convertirlos en sustancias químicas más simples, como agua, dióxido de carbono y, por supuesto, amoníaco.
Estas reacciones pueden acelerarse considerablemente con la presencia de un catalizador y de una sustancia neutra, como el sulfato de potasio (K2SO4), que eleva el punto de ebullición del ácido digestor y, por tanto, la temperatura de la reacción.
También se utilizan catalizadores para ayudar en el proceso de digestión; se han probado muchos, como el selenio, el mercurio, el cobre o los iones de mercurio o cobre.
La digestión se puede llevar a cabo de la siguiente manera:
- Pesar aproximadamente 1 g de la muestra que contiene proteínas, anotar el peso y colocar la muestra en un matraz de digestión, junto con 12-15 ml de ácido sulfúrico concentrado (H2SO4).
- Añadir siete gramos de sulfato de potasio y un catalizador, normalmente cobre.
- Llevar el tubo/frasco de digestión y la mezcla a una «ebullición» (entre 370oC y 400oC) utilizando un bloque de calentamiento.
- Calentar la mezcla en el tubo/frasco hasta que se vean humos blancos, y luego continuar el calentamiento durante unos 60-90 minutos.
- Enfriar el tubo/frasco y añadir con precaución 250 ml de agua.
Destilación
El propósito del siguiente paso, la destilación, es separar el amoníaco (es decir, el nitrógeno) de la mezcla de digestión. Esto se puede hacer de la siguiente manera:
- Elevar el pH de la mezcla con hidróxido de sodio (solución de NaOH al 45%). Esto tiene el efecto de cambiar los iones de amonio (NH4+) (que están disueltos en el líquido) a amoníaco (NH3), que es un gas.
- Separar el nitrógeno de la mezcla de digestión destilando el amoníaco (convirtiéndolo en un gas volátil, elevando la temperatura hasta el punto de ebullición) y luego atrapando los vapores destilados en una solución atrapante especial de unos 15 ml de HCl (ácido clorhídrico) en 70 ml de agua.
- Retirar el matraz de atrapamiento y enjuagar el condensador con agua para asegurarse de que todo el amoníaco se ha disuelto.
Titulación
Cuando el amoníaco se disuelve en la solución que atrapa el ácido, neutraliza parte del HCl que encuentra allí. El ácido que queda puede entonces «retrovalorarse», es decir, valorarse con una solución estándar y conocida de base (normalmente NaOH). De este modo, se puede calcular la cantidad de amoníaco destilado de la solución digestiva y, por tanto, determinar la cantidad de nitrógeno de la proteína.
La titulación en el método Kjeldahl tiene las siguientes características
- Añadir un colorante indicador a la solución de atrapamiento de ácido/amoniaco. Este tinte debe adquirir un color fuerte, lo que indica que todavía hay una cantidad significativa del ácido atrapante original.
- Poner una solución estándar de naoh (hidróxido de sodio) en la bureta (un tubo largo con un grifo en el extremo), y añadir lenta, lentamente, pequeñas cantidades de la solución de hidróxido de sodio a la solución de ácido con el colorante.
- Observar el punto en el que el colorante se vuelve naranja, lo que indica que se ha alcanzado el «punto final» y que ahora todo el ácido ha sido neutralizado por la base.
- Registrar el volumen de la base neutralizadora (solución de hidróxido de sodio) que fue necesario para alcanzar el punto final.
- Realizar un cálculo para encontrar la cantidad de amoníaco, y por tanto de nitrógeno, que procedía de la muestra original.
Cálculos
Un mol de amoníaco procedente de la mezcla de digestión (y, por tanto, de la proteína original) neutralizará exactamente un mol de ácido en el matraz de captura.
Por lo tanto, el primer cálculo consiste en encontrar el número de moles de amoníaco que se han producido y atrapado de su(s) muestra(s).
Esto se hace calculando el número de moles de ácido que había en el matraz de captura originalmente (antes de atrapar cualquier amoníaco) multiplicando la molaridad de la solución ácida por el volumen de la solución de captura.
calcular el número de moles de base (NaOH) que se añadieron desde la bureta para neutralizar el ácido restante (que NO neutralizado por el amoníaco).
restando los «moles de base» añadidos de los «moles de ácido» presentes al principio, para obtener, el número de «moles de amoníaco» procedentes de la proteína, el número de «moles de amoníaco» es el mismo que los «moles de nitrógeno», entonces, para calcular el número de gramos de nitrógeno en la muestra original de proteína, multiplique los «moles de nitrógeno» por la masa atómica del nitrógeno.
El porcentaje de nitrógeno encontrado en la muestra original puede calcularse ahora dividiendo la masa de nitrógeno hallada en la masa de la muestra digerida y multiplicar por 100.
Para más información An Overview of the Kjeldahl Method of Nitrogen Determination. Part I. Early History, Chemistry of the Procedure, and Titrimetric Finish
Como citar este artículo:
APA: (2022-09-21). Método Kjeldahl. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/metodo-kjeldahl/
ACS: . Método Kjeldahl. https://quimicafacil.net/tecnicas-de-laboratorio/metodo-kjeldahl/. Fecha de consulta 2024-07-27.
IEEE: , "Método Kjeldahl," https://quimicafacil.net/tecnicas-de-laboratorio/metodo-kjeldahl/, fecha de consulta 2024-07-27.
Vancouver: . Método Kjeldahl. [Internet]. 2022-09-21 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/metodo-kjeldahl/.
MLA: . "Método Kjeldahl." https://quimicafacil.net/tecnicas-de-laboratorio/metodo-kjeldahl/. 2022-09-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net