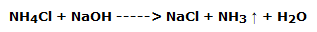Actualizado en mayo 27, 2022
Tiempo de lectura estimado: 4 minutos
El amoníaco es un compuesto de nitrógeno e hidrógeno con la fórmula NH3. El amoníaco, un hidruro binario estable y el más simple de los hidruros pnicógenos, es un gas incoloro con un olor acre característico.
Es un residuo nitrogenado común, sobre todo entre los organismos acuáticos, y contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de alimentos y fertilizantes. El amoníaco, directa o indirectamente, es también un componente para la síntesis de muchos productos farmacéuticos y se utiliza en muchos productos de limpieza comerciales. Se recoge principalmente por desplazamiento descendente tanto del aire como del agua.
Aunque es común en la naturaleza -tanto en la Tierra como en los planetas exteriores del Sistema Solar- y se utiliza ampliamente, el amoníaco es cáustico y peligroso en su forma concentrada. En Estados Unidos está clasificado como una sustancia extremadamente peligrosa y está sujeto a estrictos requisitos de información por parte de las instalaciones que lo producen, almacenan o utilizan en cantidades significativas.
La producción industrial mundial de amoníaco en 2018 fue de 175 millones de toneladas, sin cambios significativos en relación con la producción industrial mundial de 2013, que fue de 175 millones de toneladas. El amoníaco industrial se vende en forma de licor de amoníaco (normalmente un 28% de amoníaco en agua) o como amoníaco líquido anhidro presurizado o refrigerado transportado en vagones cisterna o cilindros.
Materiales
- Erlenmeyer de 200 mL
- Vaso de precipitados de 250 mL
- Embudo de Thistle
- Trípode
- Mechero Bunsen o plancha de calentamiento
- Malla de asbesto o de calentamiento
- Soporte universal
Reactivos
- Cloruro de amonio sol. 2 M y cristalino
- Hidróxido de sodio sol. 2 M
- Hidróxido de calcio cristalino
- Fenolftaleína sol.1 %
Procedimiento – síntesis de amoniaco
Se basa en la sencilla reacción de doble intercambio entre el cloruro de amonio y el hidróxido de sodio:
Verter en un erlenmeyer de 200 mL unos 50 mL de cloruro amónico sol. 2M y la misma cantidad de hidróxido sódico sol. 2M.
En un vaso de precipitados se vierten unos 100 mL de agua destilada y unas gotas de fenolftaleína; obviamente no se observa ningún cambio de color.
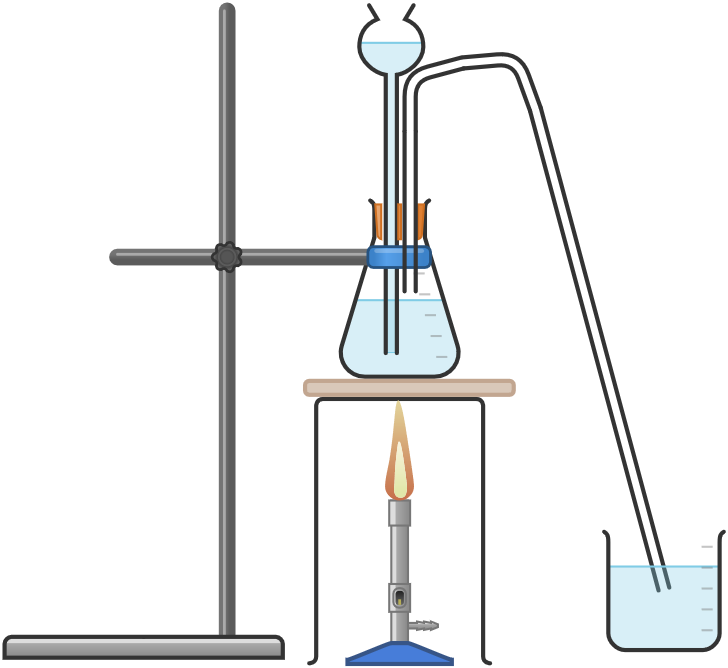
Cerrar el matraz Erlenmeyer con un tapón que lleve un pequeño tubo de vidrio por donde conducir el gas producido, colocarlo en un trípode con una malla de amianto colocada sobre un mechero bunsen, procediendo a un calentamiento lento.
En cuanto empiece la ebullición, sumergir el extremo del tubo en el agua del vaso de precipitados, haciendo que el gas producido por la reacción burbujee.
En unos segundos el agua del vaso de precipitados se vuelve violeta, lo que indica un estado básico debido a la disolución del amoníaco.
Cuando el gas se libera en el aire, se percibe el típico olor acre.
El siguiente dibujo muestra un sistema completo de producción y recogida de gas:
Un experimento similar, pero ciertamente más rápido, puede realizarse mezclando en la palma de la mano debidamente protegida con un guante o en una capsula de porcelana sostenida en la mano una espátula de cloruro de amonio y otra de hidróxido de calcio y frotando con un dedo. En poco tiempo olerá el típico olor del amoníaco formado por la reacción:
Nota: las soluciones a las que se refiere la primera parte también pueden ser de distinta potencia, pero suficientemente concentradas o pueden prepararse en fresco disolviendo una espátula de ambos reactivos en agua.
Después del laboratorio
Realizar los cálculos estequiométricos según ambas reacciones planteadas para obtener 1 litro de amonio gaseoso en condiciones normales
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Introduction to Ammonia Production
Como citar este artículo:
APA: (2021-08-04). Síntesis de amoniaco. Recuperado de https://quimicafacil.net/manual-de-laboratorio/sintesis-de-amoniaco/
ACS: . Síntesis de amoniaco. https://quimicafacil.net/manual-de-laboratorio/sintesis-de-amoniaco/. Fecha de consulta 2024-07-27.
IEEE: , "Síntesis de amoniaco," https://quimicafacil.net/manual-de-laboratorio/sintesis-de-amoniaco/, fecha de consulta 2024-07-27.
Vancouver: . Síntesis de amoniaco. [Internet]. 2021-08-04 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/sintesis-de-amoniaco/.
MLA: . "Síntesis de amoniaco." https://quimicafacil.net/manual-de-laboratorio/sintesis-de-amoniaco/. 2021-08-04. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net