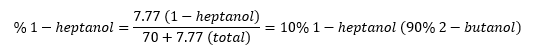Actualizado en enero 9, 2024
Tiempo de lectura estimado: 9 minutos
La cuantificación en cromatografía de gases es una de las aplicaciones practicas más importantes de esta técnica, con uso en muchas industrias y laboratorios.
Fundamento de la cuantificación en cromatografía de gases
El área bajo un pico es proporcional a la cantidad de analito presente en el cromatograma. Calculando el área del pico mediante la función matemática de integración, se puede determinar la concentración de un analito en la muestra original. La concentración puede calcularse utilizando una curva de calibración creada al encontrar la respuesta para una serie de concentraciones de analito, o determinando el factor de respuesta relativa de un analito.
El factor de respuesta relativa es la relación esperada entre un analito y un estándar interno (o estándar externo) y se calcula encontrando la respuesta de una cantidad conocida de analito y una cantidad constante de estándar interno (una sustancia química añadida a la muestra a una concentración constante, con un tiempo de retención distinto al del analito).
En la mayoría de los sistemas modernos de GC-MS, se utiliza un software informático para dibujar e integrar los picos, y hacer coincidir los espectros de MS con los de la biblioteca.
Retos cuantitativos
La mayoría de los instrumentos de cromatografía modernos permiten integrar los picos de un espectro de cromatografía con sólo pulsar un botón. Si se utiliza un instrumento más antiguo, se puede utilizar la triangulación para calcular el área bajo un pico, o se pueden recortar los picos de un espectro en papel y pesarlos en una balanza analítica para integrarlos.
Las integraciones de picos son útiles porque es posible correlacionar el área bajo un pico con la cantidad de material presente en una muestra. Hay que tener en cuenta que lo relevante es el área de un pico, no la altura. Un pico alto y estrecho puede tener un área menor que uno corto y ancho. Sería muy útil que las áreas de los picos reflejaran directamente la composición de la mezcla, pero lamentablemente no siempre es así. La razón de esto tiene que ver con la forma en que se detectan los compuestos al salir de una columna.
Los detectores más comunes en las instituciones de grado son los detectores de ionización de llama (FID) y los detectores de espectrometría de masas (MS). Con un FID, la muestra se enciende al salir de la columna y los iones producidos en la llama se «cuentan» por la cantidad de corriente eléctrica. Lamentablemente, diferentes compuestos producen diferentes cantidades de iones cuando se queman, lo que significa que el recuento de iones no será directamente equivalente a la cantidad molar.
Del mismo modo, un espectrómetro de masas cuenta el número de iones producidos a partir de todos los fragmentos detectados en el instrumento (llamado «recuento total de iones», TIC, el eje y de la figura 1), que no siempre representa directamente la cantidad del material original. Algunos compuestos se fragmentan más que otros en un espectrómetro de masas, lo que hace que se detecten de una manera que no representa su verdadera abundancia.

Para demostrar que la integración de los picos no siempre se corresponde con la abundancia real, en la figura 1 se muestran los espectros de cromatografía de dos muestras que contienen cantidades equimolares de dos compuestos. La figura 1a contiene cantidades molares iguales de 1-butanol y 2-butanol, mientras que la figura 1b contiene cantidades molares iguales de 2-butanol y 1-heptanol.
El área bajo los picos fue tabulada por el espectrómetro de masas (representada por la columna indicada por una flecha en cada Figura), y fue de casi el 50% para cada componente del sistema de butanol (Figura 1a). En este caso, los porcentajes generados por el instrumento eran casi idénticos a la composición real (¡aunque no es probable que se llegue a cinco cifras significativas!).
Sin embargo, la muestra que contenía cantidades equimolares de 2-butanol y 1-heptanol fue reportada como una composición ∼20% – 80% (Figura 1b). La verdadera composición de la mezcla es del 50% de cada componente, pero los compuestos se «cuentan» de forma desproporcionada. En esta situación, las integraciones no representan la verdadera abundancia, ya que el 1-heptanol forma más fragmentos en su espectro de masas que el 2-butanol, por lo que se «cuenta» con más frecuencia.
Es una regla general que las integraciones en un espectro de cromatografía (los porcentajes) pueden utilizarse directamente como una primera aproximación a la verdadera composición cuando se comparan isómeros (por ejemplo, 1-butanol y 2-butanol). Cuando se comparan compuestos de tamaños diferentes (por ejemplo, 2-butanol y 1-heptanol), puede ser necesario traducir los porcentajes notificados a porcentajes reales utilizando una curva de calibración o factores de respuesta.
Uso de una curva de calibración
Un método para traducir los valores de integración dados por el instrumento de cromatografía en porcentajes significativos que reflejen la composición de la mezcla es utilizar una curva de calibración. Para generar una curva de calibración, se inyectan en la cromatografía muestras estándar de proporciones molares o de masa conocidas y se registran los porcentajes indicados por el instrumento. El gráfico de la figura 2 muestra una curva de calibración de este tipo para una mezcla de 2-butanol/1-heptanol, detectada por un espectrómetro de masas.
Por ejemplo, si una mezcla que se sabe que tiene un 60mol% de 2-butanol y 40mol% de 1-heptanol, y el espectro de cromatografía resultante indica que la mezcla tiene un 42% de 2-butanol y un 58% de 1-heptanol, este punto de datos se registraría en el gráfico como (60,42), utilizando sólo el porcentaje de 2-butanol para simplificar la situación. Se podrían analizar más puntos de datos utilizando varias relaciones molares conocidas de 2-butanol y 1-heptanol.

La curva de calibración puede utilizarse para correlacionar los valores notificados por el instrumento de cromatografía con las verdaderas abundancias. Imagínese que se inyecta en el cromatógrafo una muestra que sólo contiene 2-butanol y 1-heptanol y que el instrumento indica que tiene un 70% de 2-butanol.
Utilizando la curva de calibración de la Figura 2, un valor medido de 70% de 2-butanol (eje y) se correlaciona con un valor real de aproximadamente 87 mol% de 2-butanol (eje x). Por lo tanto, una muestra que, según el instrumento de cromatografía, tiene un 70/30% de 2-butanol/1-heptanol, en realidad está más cerca del 87/13% de 2-butanol/1-heptanol.
Debido a la naturaleza aproximada de este método, los valores porcentuales nunca deben ser reportados con más precisión que la del lugar, y probablemente el verdadero error es del orden de ±5%.
Usando factores de respuesta
Otro método que puede utilizarse para traducir los valores de integración dados por el instrumento de cromatografía en porcentajes significativos es utilizar un factor de respuesta. Se inyecta en el cromatógrafo una muestra que contiene cantidades equimolares de los compuestos que se van a analizar y las áreas de los picos se traducen numéricamente en sensibilidades de los compuestos.
Este proceso se demostrará con una mezcla que contiene sólo 2-butanol y 1-heptanol. La figura 3 muestra el espectro de cromatografía de una muestra que contiene cantidades equimolares de 2-butanol y 1-heptanol.
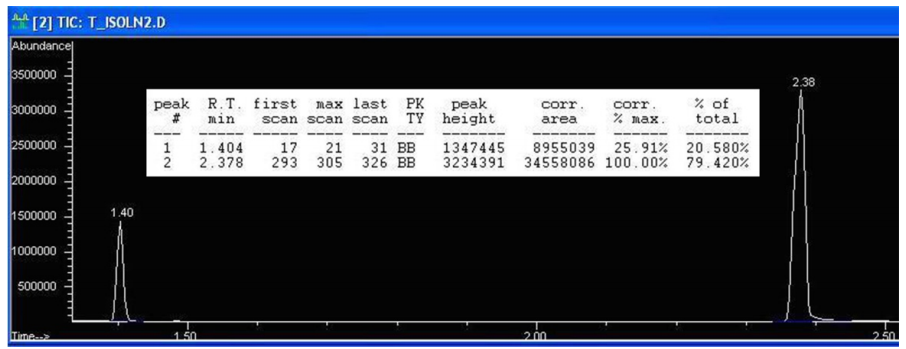
Para utilizar este factor de respuesta en la correlación de los valores notificados por el instrumento con las verdaderas abundancias, imagine que una muestra que sólo contiene 2-butanol y 1-heptanol es notificada por el cromatógrafo con un 30% de 1-heptanol (30 recuentos de área de 1-heptanol por cada 70 recuentos de área de 2-butanol). Como el 1-heptanol es 3,86 veces más sensible que el 2-butanol, los recuentos de área verdaderos se representarían más exactamente como 30/3,86=7,77 recuentos de área de 1-heptanol por cada 70 recuentos de área de 2-butanol.
Estos recuentos de superficie hipotéticos (y sin embargo más precisos) pueden convertirse en porcentajes, como se indica a continuación:
Por lo tanto, una muestra que el instrumento de cromatografía indica que tiene un 70/30% de 2-butanol/1-heptanol, en realidad está más cerca del 90/10% de 2-butanol/1-heptanol, que es un valor similar al que se podría encontrar utilizando una curva de calibración.
Estos cálculos podrían realizarse de forma más sucinta y con mayor precisión utilizando los recuentos de área reales de cada pico, que se encuentran en la columna «área corr.» de un informe cuantitativo de cromatografía.
Para más información Quantitating with GC
Como citar este artículo:
APA: (2021-03-10). Cuantificación en cromatografía de gases. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/cuantificacion-en-cromatografia-de-gases/
ACS: . Cuantificación en cromatografía de gases. https://quimicafacil.net/tecnicas-de-laboratorio/cuantificacion-en-cromatografia-de-gases/. Fecha de consulta 2024-07-27.
IEEE: , "Cuantificación en cromatografía de gases," https://quimicafacil.net/tecnicas-de-laboratorio/cuantificacion-en-cromatografia-de-gases/, fecha de consulta 2024-07-27.
Vancouver: . Cuantificación en cromatografía de gases. [Internet]. 2021-03-10 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/cuantificacion-en-cromatografia-de-gases/.
MLA: . "Cuantificación en cromatografía de gases." https://quimicafacil.net/tecnicas-de-laboratorio/cuantificacion-en-cromatografia-de-gases/. 2021-03-10. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net