Actualizado en enero 9, 2024
Tiempo de lectura estimado: 14 minutos
El procedimiento de cristalización es posible porque la mayoría de los sólidos tienden a ser más solubles en los disolventes a medida que aumenta su temperatura
Perfil ideal de temperatura
El procedimiento de cristalización es posible ya que la mayoría de los sólidos tienden a hacerse más solubles en los disolventes a medida que aumenta su temperatura (la figura 1 muestra un sólido amarillo que se disuelve en etanol a medida que aumenta la temperatura en una placa caliente).

La cafeína es un sólido blanco que sigue este patrón habitual, ya que 1 gramo de cafeína se disuelve en 46 mL de agua a temperatura ambiente, 5,5mL de agua a 80°C y 1,5 mL de agua hirviendo. Si alguna vez ha tenido dificultades para limpiar los restos de almidón solidificado de un colador de cocina (quizás después de haber colado el agua de la pasta), habrá aprendido que el colador se limpia más fácilmente en agua caliente que en fría. El almidón tiene una mayor solubilidad en el agua caliente, y esta tendencia a la solubilidad es en parte lo que hace que el lavavajillas sea tan eficaz.
El perfil de solubilidad de los compuestos es una determinación empírica. Algunos sólidos aumentan su solubilidad de forma regular con la temperatura (figura 2a), y otros lo hacen de forma exponencial (figura 2b).
En casos inusuales, la solubilidad de un sólido puede disminuir con la temperatura. Para una mejor cristalización, el compuesto debe ser muy soluble en el disolvente caliente y mínimamente soluble (o insoluble) en el disolvente frío.

Procedimientos generales de eliminación de impurezas
La cristalización funciona bien como técnica de purificación si las impurezas están presentes en cantidades muy pequeñas (menos del 5% mol del sólido), o si las impurezas tienen un perfil de solubilidad muy diferente al del compuesto deseado. Las impurezas pueden eliminarse fácilmente si son mucho más solubles o mucho menos solubles en el disolvente que el compuesto de interés.
La figura 3 muestra la secuencia de procedimiento utilizada para eliminar una «impureza soluble» de un sólido impuro, es decir, una impureza que está incrustada en la matriz cristalina, pero que sería completamente soluble en el disolvente de cristalización.
El sólido impuro se disuelve primero completamente en la cantidad mínima de disolvente caliente para liberar las impurezas atrapadas en el interior del sólido. Al enfriar, una impureza completamente soluble permanecerá disuelta en el licor madre mientras el compuesto deseado cristaliza. El sólido cristalizado puede entonces recogerse mediante filtración por succión.

La figura 4 muestra la secuencia de procedimiento utilizada para eliminar una «impureza insoluble» de un sólido impuro, es decir, una impureza que está incrustada en la matriz cristalina, pero que sería insoluble en el disolvente de cristalización.
El sólido impuro se calienta en la cantidad mínima de disolvente caliente necesaria para disolver el compuesto deseado. A continuación, el material insoluble se filtra mientras la solución se mantiene caliente (lo que se denomina «filtración en caliente»), y luego el compuesto deseado se cristaliza y se recoge mediante filtración por succión.

Determinación del disolvente a utilizar
El factor más importante para el éxito de la cristalización es probablemente el disolvente elegido. Además de tener las propiedades de solubilidad cruciales para la cristalización (el compuesto debe ser soluble en el disolvente caliente y tan insoluble como sea posible en el disolvente frío), hay otros factores que determinan un disolvente apropiado.
Un disolvente de cristalización ideal debe ser poco reactivo, barato y de baja toxicidad. También es importante que el disolvente tenga un punto de ebullición relativamente bajo (p.eb. a menudo < 100°C
ya que es mejor que el disolvente se evapore fácilmente del sólido una vez recuperado. La tabla 1 muestra una lista de disolventes comunes utilizados en la cristalización. El tolueno tiene el punto de ebullición más alto (111°C) de la lista, y debe evitarse si existen alternativas por esta razón (además de su toxicidad y olor). Junto con la evaporación rápida, un disolvente de ebullición relativamente baja también es ideal para la cristalización, ya que minimiza la probabilidad de que un compuesto se «engrase», donde el material sale de la solución por encima de su punto de fusión y forma un líquido en lugar de un sólido. Cuando un compuesto se licua primero, rara vez cristaliza bien.

Los disolventes con puntos de ebullición muy bajos (por ejemplo, el éter dietílico, la acetona y el éter de petróleo de bajo punto de ebullición) son muy inflamables y pueden ser difíciles de trabajar porque se evaporan con facilidad. Pueden utilizarse con cuidado, pero si existen alternativas, suelen ser preferibles.
Existen algunas tendencias generales a la hora de predecir el disolvente adecuado para un determinado compuesto. Como el compuesto debe ser soluble en el disolvente en ebullición, ayuda que el compuesto y el disolvente tengan fuerzas intermoleculares similares.
Por ejemplo, si un compuesto puede formar enlaces de hidrógeno (alcoholes, ácidos carboxílicos y aminas), a veces puede cristalizar del agua. Si un compuesto tiene una polaridad moderada, a veces se cristaliza a partir del etanol. Si un compuesto es mayoritariamente no polar, a veces se cristaliza a partir de éter de petróleo o hexanos, o puede requerir un disolvente mixto.
Como puede ser difícil predecir el disolvente ideal para la cristalización, a menudo un procedimiento publicado en un artículo de revista indicará el disolvente apropiado. Si no se indica ningún disolvente, se puede predecir un disolvente adecuado utilizando los datos de solubilidad (sección siguiente), determinarlos experimentalmente o elegirlos a partir de Perrin’s Purification of Organic Chemicals, un libro de referencia que enumera los procedimientos de purificación de unos 5.700 compuestos conocidos.
Uso de datos de solubilidad
Si no está siguiendo un procedimiento en el que se haya especificado un disolvente de cristalización, puede ser útil consultar los datos de solubilidad del compuesto deseado. Se pueden encontrar datos de solubilidad cualitativos (y a veces cuantitativos) para muchos compuestos en el CRC y en el Merck Index.
Si el objetivo es utilizar un solo disolvente para la cristalización, lo mejor es buscar un disolvente en el que el compuesto deseado sea ligeramente soluble. Aunque el porcentaje de recuperación será inferior al 100% (una parte permanecerá en el líquido madre), hay muchas posibilidades de que un sólido ligeramente soluble se disuelva al calentarse. Es posible que los disolventes catalogados como insolubles no disuelvan el compuesto a ninguna temperatura.
Por ejemplo, a continuación, se muestran las entradas en el índice CRC y Merck para el compuesto 1,4-dinitrobenceno:
- Manual CRC: «i H2O ; sl EtOH chl; s ace, bz, tol» Traducción: El compuesto es insoluble en agua; ligeramente soluble en etanol y cloroformo; y soluble en acetona, benceno y tolueno.
- Índice Merck: «Cristales blancos. . un gramo se disuelve en 12.500 mL de agua fría, 555 mL de agua hirviendo, 300 mL de alcohol; poco soluble en benceno, cloroformo, acetato de etilo». Traducción: El compuesto es muy insoluble en agua fría, pero mucho más soluble en agua caliente. Es ligeramente soluble en etanol, y básicamente insoluble en benceno, cloroformo y acetato de etilo.
El 1,4-dinitrobenceno es ligeramente soluble en etanol, lo que lo convierte en una buena «primera opción» como disolvente de cristalización. De hecho, Perrin’s Purification of Organic Chemicals recomienda la cristalización del 1,4-dinitrobenceno utilizando etanol o acetato de etilo.
Ensayos experimentales con disolventes
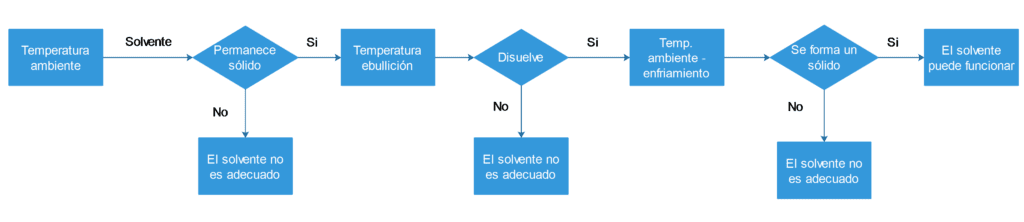
Para determinar experimentalmente un único disolvente para la cristalización, utilice el siguiente procedimiento. En la figura 5 se muestra un diagrama de flujo que describe este proceso.
- Coloque 100 mg del sólido a cristalizar en un tubo de ensayo y añada 3mL de disolvente. (Estas cantidades se corresponden con la pauta habitual de solubilidad, donde un compuesto se considera «soluble» si 3 g de compuesto se disuelven en 100 mL de disolvente). Nota: las cantidades pueden reducirse en función de la disponibilidad del compuesto.
- Mientras se sujeta el tubo de ensayo por la parte superior, se agita el tubo para mezclar enérgicamente el contenido.
- Si el sólido se disuelve completamente a temperatura ambiente, el disolvente no funcionará para la cristalización, ya que debe ser insoluble en frío. Si el sólido parece permanecer insoluble, el disolvente puede funcionar.
- Llevar a ebullición el sólido suspendido en el disolvente mediante un baño de vapor o de agua caliente. Si el sólido se disuelve cuando el disolvente está hirviendo, puede funcionar para la cristalización, ya que tiene que ser soluble en caliente. Si nunca se disuelve en el disolvente caliente, el disolvente no funcionará.
- Si el sólido se disuelve en el disolvente caliente, deje que se enfríe a temperatura ambiente y luego sumérjalo en un baño de hielo durante 10-20 minutos. Si la mayoría de los cristales vuelven, el disolvente debería funcionar para la cristalización. Si vuelven pocos cristales o ninguno, intente rascar el matraz con una varilla de vidrio para iniciar la cristalización. Si los cristales siguen sin volver, el disolvente no funcionará para la cristalización.
Este procedimiento de ensayo se muestra para la N-bromosuccinimida en la figura 6, utilizando agua como disolvente.

Mezcla de disolventes
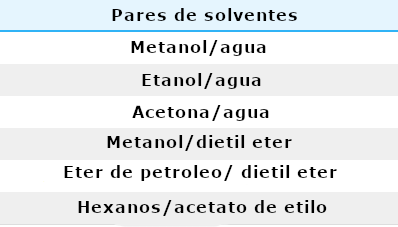
Cuando no se puede encontrar un único disolvente que cumpla todos los criterios para la cristalización, puede ser posible utilizar un disolvente mixto. Se elige un par de disolventes: uno en el que el compuesto es soluble (llamado «disolvente soluble») y otro en el que el compuesto es insoluble (llamado «disolvente insoluble»). Los dos disolventes deben ser miscibles entre sí para que su solubilidad mutua no limite las proporciones utilizadas. La tabla 2 muestra una lista de disolventes mixtos comunes utilizados en la cristalización.
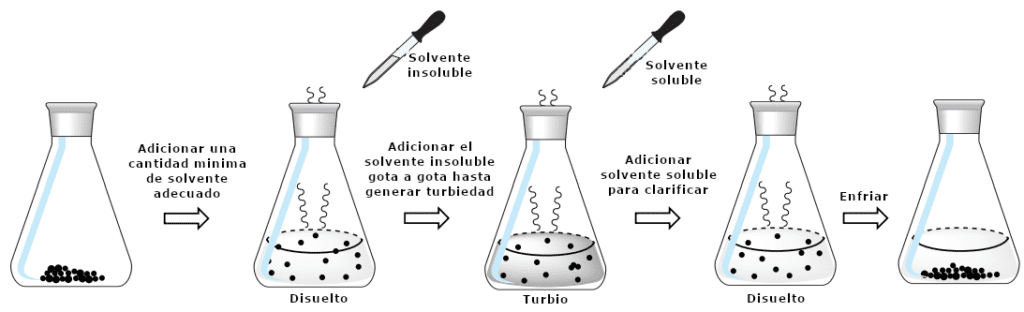
Para llevar a cabo una cristalización utilizando un disolvente mixto, el sólido a cristalizar se disuelve primero en la cantidad mínima de «disolvente soluble» caliente, y luego se añade gota a gota el «disolvente insoluble» caliente hasta que la solución se vuelve ligeramente turbia. A continuación, se añade una pequeña porción adicional de disolvente soluble caliente para clarificar la solución, y ésta se aparta para que se enfríe lentamente y cristalice. En la figura 7 se muestra un diagrama que describe este proceso.
Aunque este procedimiento puede producir buenos resultados, cuando es posible suele ser mejor utilizar un único disolvente para la cristalización. Cuando se calienta un disolvente mixto, la composición puede cambiar a medida que los disolventes se evaporan a diferentes velocidades, lo que puede afectar a la solubilidad del compuesto en el disolvente mixto. Además, las cristalizaciones de los disolventes mixtos a veces se «engrasan», cuando el compuesto disuelto sale de la solución por encima de su punto de fusión y forma un líquido en lugar de un sólido.
Para probar la cristalización de un disolvente mixto, utilice el procedimiento que sigue. Este proceso se demuestra cristalizando el ácido trans-cinámico a partir de un disolvente mixto de agua y metanol (Figuras 8 + 9).

Utilice el método descrito anteriormente (100 mg de compuesto en 3mL de disolvente), para encontrar un par de disolventes: un disolvente en el que el compuesto es soluble y un disolvente en el que el compuesto es insoluble (Figura 8). Los disolventes deben ser miscibles entre sí.
Coloque 100 mg frescos del sólido a cristalizar en un tubo de ensayo y añadir el «disolvente soluble» gota a gota mientras se calienta (con un baño de vapor o un baño de agua caliente, Figura 9a) hasta que el sólido se disuelva. La suspensión debe sumergirse en la fuente de calor después de cada gota, y debe dejarse un tiempo entre las adiciones para el proceso de disolución, a veces lento.
Añadir el «disolvente insoluble» gota a gota mientras se calienta hasta que la solución se vuelva ligeramente turbia (Figura 9c).
Añadir el «disolvente soluble» gota a gota mientras se calienta hasta que la solución se aclare (transparente).
Deje que el sistema se enfríe a temperatura ambiente (figura 9e) y, a continuación, sumérjalo en un baño de hielo durante 10-20 minutos. Si vuelven los cristales, el disolvente mezclado puede funcionar para la cristalización.

Para más información Choice of Solvent
Como citar este artículo:
APA: (2021-05-05). Cristalización – elección del solvente. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/cristalizacion-eleccion-del-solvente/
ACS: . Cristalización – elección del solvente. https://quimicafacil.net/tecnicas-de-laboratorio/cristalizacion-eleccion-del-solvente/. Fecha de consulta 2024-07-27.
IEEE: , "Cristalización – elección del solvente," https://quimicafacil.net/tecnicas-de-laboratorio/cristalizacion-eleccion-del-solvente/, fecha de consulta 2024-07-27.
Vancouver: . Cristalización – elección del solvente. [Internet]. 2021-05-05 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/cristalizacion-eleccion-del-solvente/.
MLA: . "Cristalización – elección del solvente." https://quimicafacil.net/tecnicas-de-laboratorio/cristalizacion-eleccion-del-solvente/. 2021-05-05. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net