Actualizado en enero 9, 2024
Tiempo de lectura estimado: 14 minutos
Antes de emplear una cristalización como técnica de purificación, es necesario tener en cuenta una serie de generalidades para tener éxito en la purificación del compuesto de interés.
La mayoría de las veces se le pedirá que siga un procedimiento de cristalización publicado que puede estar escrito en una de las dos variedades:
- El sólido A se cristalizó utilizando el disolvente Y, o
- El sólido A se cristalizó utilizando X mL de disolvente Y
Cuando no se especifica ningún volumen de disolvente, el proceso debe realizarse utilizando el volumen mínimo de disolvente en ebullición para disolver el sólido. Si se especifica un volumen, probablemente signifique que la cristalización es complicada y que ensayos anteriores han demostrado que un volumen de disolvente superior al mínimo produce cristales de mayor calidad, o que el intento de disolver impurezas comunes lleva a utilizar una cantidad de disolvente demasiado grande.
El proceso de cristalización estándar (Figura 1a) se resume como sigue:
- Disolver el sólido impuro en la mínima cantidad de disolvente caliente.
- Enfriar lentamente la solución para inducir la cristalización.
- Enfriar aún más la solución en un baño de hielo.
- Recoger el sólido por filtración de succión.
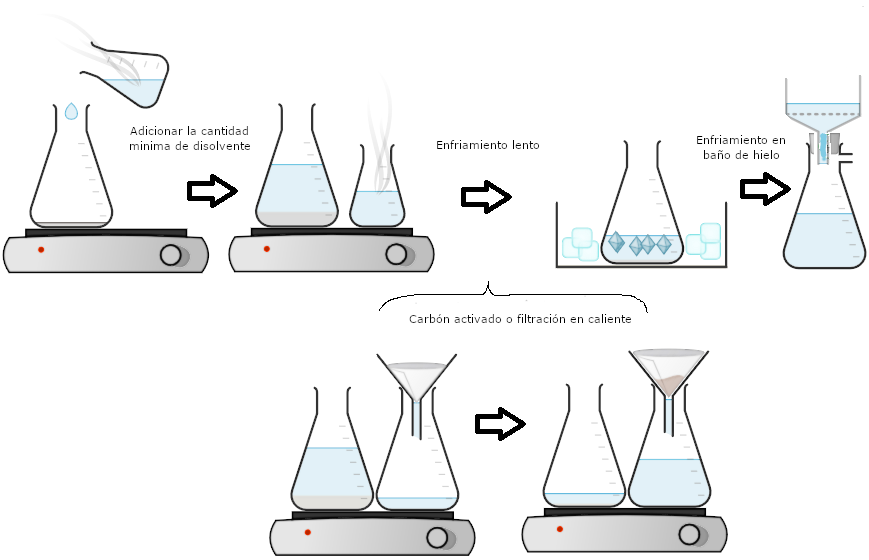
Se puede insertar un paso adicional en este proceso general (entre los pasos 1 y 2) si hay impurezas insolubles, o si las impurezas se eliminarán con carbón vegetal (Figura 1b). Una vez disuelto el compuesto en la cantidad mínima de disolvente caliente, se puede utilizar carbón vegetal o eliminar las impurezas insolubles con filtración en caliente. El proceso general puede entonces continuar para el siguiente enfriamiento de la solución e inducir la cristalización.
Fuente de calor y prevención de golpeo

Las cristalizaciones se realizan generalmente utilizando una placa caliente o un baño de vapor, y el disolvente de la cristalización puede afectar a la fuente de calor adecuada. Si el disolvente de cristalización es agua, se puede utilizar una placa caliente, ya que no hay problemas de inflamabilidad. Si el disolvente de cristalización es altamente inflamable o volátil (por ejemplo, éter dietílico, éter de petróleo de bajo punto de ebullición o acetona), los vapores producidos durante la ebullición podrían inflamarse en la superficie caliente de una placa caliente, por lo que es esencial utilizar un baño de vapor. Los disolventes con una volatilidad moderada (por ejemplo, etanol o acetato de etilo), deben calentarse preferentemente con un baño de vapor, pero pueden calentarse con seguridad con una placa caliente si se tiene extremo cuidado y precaución.

Uso de carbón activado en la cristalización
El carbón activado se utiliza a veces para eliminar pequeñas cantidades de impurezas coloreadas de la solución. El carbón activado tiene una gran afinidad por los compuestos conjugados, cuyas estructuras planas se acoplan bien entre las láminas de grafeno. La cantidad utilizada debe ser limitada, ya que el carbón vegetal adsorbe todos los compuestos en cierta medida y podría conducir a una menor recuperación del compuesto deseado. Por supuesto, el carbón vegetal no debe utilizarse si el producto está coloreado.
El carbón decolorante (Norit) se añade después de que el sólido se haya disuelto en la cantidad mínima de disolvente caliente. Al principio debe utilizarse una pequeña porción; sólo la cantidad que pueda caber en la punta de una espátula (del tamaño de medio guisante, véase la figura 2b). Al añadir el carbón, se recomienda retirar temporalmente la solución de la fuente de calor o la elevada superficie del carbón puede hacer que las zonas sobrecalentadas hiervan inmediatamente. Las áreas sobrecalentadas son regiones donde la temperatura está por encima del punto de ebullición del disolvente, pero carecen de un sitio de nucleación para crear una burbuja e iniciar el cambio de fase. Si el carbón vegetal se añade directamente a una solución casi en ebullición, la solución puede hervir.

En el caso de soluciones con bastante color, la primera porción de carbón vegetal es probablemente todo lo que se necesita, y la solución resultante debería ser de un gris tenue (Figura 2c). Se puede añadir más carbón vegetal si el color permanece (Figura 3c). Las partículas de carbón vegetal son tan finas que es necesario filtrarlas en caliente para eliminarlas antes de la cristalización.

No es necesario utilizar carbón vegetal con todas las soluciones coloreadas, incluso si el compuesto deseado es blanco. Pueden quedar impurezas coloreadas en el licor madre después de la filtración. Por ejemplo, la secuencia de la Figura 4 muestra la purificación de acetanilida (un sólido blanco) que se ha contaminado con varias gotas de solución de rojo de metilo para producir un sólido naranja (Figura 4a). El sólido se cristalizó a partir de agua caliente sin utilizar carbón vegetal, y aunque el licor madre era amarillo (Figura 4b), el sólido cristalizado seguía siendo de color blanco puro (Figura 4c). La «impureza» roja de metilo permaneció en el licor madre y no se incorporó obviamente a la red cristalina de la acetanilida.

Como comparación, el mismo sólido se decoloró con carbón vegetal, se filtró y se cristalizó, como se muestra en la Figura 5. El carbón vegetal eliminó el color rojo de metilo, y el licor madre era incoloro (como se indica con una flecha en la Figura 5b), pero no hubo una mejora evidente del color en el sólido cristalizado resultante (Figura 5c). Además, hubo una pérdida de rendimiento cuando se utilizó carbón vegetal. Cuando no se utilizaba carbón vegetal, la recuperación era del 63%, lo que coincidía con otros ensayos de acetanilida.
Sin embargo, cuando se utilizó carbón vegetal, la recuperación fue del 53%. La pérdida de rendimiento puede atribuirse a la absorción por parte del carbón vegetal del compuesto objetivo junto con la impureza coloreada, así como a la pérdida de compuesto en el papel de filtro durante la filtración en caliente. Por esta razón, el carbón vegetal sólo debe utilizarse si se especifica en un procedimiento, o si los ensayos de cristalización anteriores no lograron eliminar las impurezas coloreadas.

Enfriamiento lento
Una vez disuelta la solución en la cantidad mínima de disolvente caliente y filtrada (si procede), la solución debe enfriarse lo más lentamente posible (teniendo en cuenta las limitaciones de tiempo en un laboratorio). Para lograr este objetivo:
La boca del matraz Erlenmeyer debe cubrirse con un vidrio de reloj (figura 6a). Esto retiene el calor de la misma manera que se coloca una tapa en una olla hirviendo. El vidrio de reloj también evita el exceso de evaporación de los disolventes de bajo punto de ebullición. A menudo se observa condensación en el vidrio de reloj cuando la solución se enfría, lo que demuestra que los vapores calientes quedan atrapados con este método.
El matraz debe colocarse sobre una superficie no conductora para que el calor no se pierda en el fondo del matraz. El matraz puede colocarse sobre una toalla de papel doblada varias veces, un bloque de madera o un anillo de corcho invertido (Figura 6a-c).
Para las soluciones que se enfrían muy rápidamente (por ejemplo, cuando se utilizan disolventes con puntos de ebullición bajos como el éter dietílico y la acetona), el matraz también puede cubrirse con un vaso de precipitados invertido (Figura 6d) para crear una atmósfera aislante alrededor del matraz. Esto no suele ser necesario para los disolventes con puntos de ebullición relativamente altos, como el agua y el etanol.

Debe utilizarse el tamaño de matraz correcto para que la cantidad de disolvente caliente utilizado alcance una altura de más de 1 cm en el matraz. Si el nivel de disolvente es demasiado superficial durante la cristalización, la elevada superficie hará que la solución se enfríe y se evapore demasiado rápido (Figura 7b).
También será difícil filtrar un volumen poco profundo. Lo ideal es que la solución esté a una altura de al menos 2 cm en el matraz, lo que permite mantener el calor por el interior de la solución (Figura 7d). Es habitual utilizar entre 10 y 50 veces más disolvente que muestra, y una guía aproximada es utilizar un matraz en el que la muestra apenas cubra el fondo en una capa fina.

Inicio de la cristalización
A veces, los cristales no se forman incluso cuando una solución está sobresaturada, ya que existe una barrera cinética para la formación de cristales. A veces puede ser necesario iniciar la cristalización, por ejemplo, si la solución se enturbia ligeramente al enfriarse, o si la solución no produce cristales, aunque esté notablemente más fría que al principio. Los métodos descritos en esta sección deben emplearse preferentemente en soluciones que aún están calientes, ya que iniciar la cristalización en soluciones ya frías (o en frío) provocará una cristalización demasiado rápida.

El método más sencillo para iniciar la cristalización es rascar el fondo o el lateral del matraz con una varilla agitadora de vidrio (Figura 8a), con la suficiente fuerza como para que el rascado sea audible (pero, por supuesto, no tanto como para romper el vidrio). La cristalización suele comenzar inmediatamente después del rayado, y pueden verse líneas que muestran el crecimiento de los cristales en las zonas del vidrio que se rayaron (Figura 9).

Aunque no hay duda de que este método funciona, hay diferencias de opinión en cuanto al mecanismo de acción. Una de las teorías es que el rascado inicia la cristalización al proporcionar la energía de las vibraciones de alta frecuencia. Otra teoría es que durante el rascado se desprenden pequeños fragmentos de vidrio que proporcionan lugares de nucleación para la formación de cristales.
Otra hipótesis es que el disolvente puede evaporarse de la varilla de agitación de vidrio después de retirarla, y una mota de sólido puede caer en la solución y actuar como un «cristal semilla» (véase el siguiente párrafo). No se sabe muy bien cómo el rayado inicia la cristalización, pero está en el arsenal de «trucos» de todo químico.
Hay algunos otros métodos que pueden utilizarse para iniciar la cristalización cuando el rayado falla:
- Añadir un «cristal semilla»: una pequeña mota de sólido crudo guardada de antes de iniciar la cristalización, o un poco de sólido puro de un frasco de reactivos. Los cristales semilla crean un lugar de nucleación donde los cristales pueden empezar a crecer.
- Sumergir una varilla de vidrio para agitar en la solución sobresaturada, retírela y deje que el disolvente se evapore para producir un fino residuo de cristales en la varilla (Figura 10a). A continuación, toque la varilla con la superficie de la solución, o agite la solución con la varilla para desprender los pequeños cristales semilla.

Si al rayar y sembrar los cristales no se inicia la cristalización, es posible que haya demasiado disolvente presente y que el compuesto siga siendo completamente soluble (Figura 11). Para comprobarlo, vuelva a llevar la solución a ebullición y reduzca el volumen de disolvente, quizás a la mitad (Figura 11c). Deje que la solución reducida se enfríe y vea si se forma un sólido. Si lo hace (Figura 11d), la cantidad de disolvente era definitivamente el problema, y se puede experimentar con los volúmenes de disolvente para conseguir el mejor crecimiento de los cristales.

Utiliza un baño a baja temperatura para intentar favorecer la formación de cristales. Un baño de agua salada y hielo (-10°C) o un enfriamiento químico son algunas opciones.
Para más información Procedural Generalities
Como citar este artículo:
APA: (2021-06-30). Generalidades de la cristalización. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/generalidades-de-la-cristalizacion/
ACS: . Generalidades de la cristalización. https://quimicafacil.net/tecnicas-de-laboratorio/generalidades-de-la-cristalizacion/. Fecha de consulta 2024-07-27.
IEEE: , "Generalidades de la cristalización," https://quimicafacil.net/tecnicas-de-laboratorio/generalidades-de-la-cristalizacion/, fecha de consulta 2024-07-27.
Vancouver: . Generalidades de la cristalización. [Internet]. 2021-06-30 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/generalidades-de-la-cristalizacion/.
MLA: . "Generalidades de la cristalización." https://quimicafacil.net/tecnicas-de-laboratorio/generalidades-de-la-cristalizacion/. 2021-06-30. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net