Actualizado en enero 8, 2024
Tiempo de lectura estimado: 6 minutos
En una extracción liquido – liquido se manejan dos capas a las que generalmente se les denomina capa orgánica y capa acuosa. También se les puede denominar fases. Se usarán ambos términos de manera indistinta.
¿Qué capa es cuál?
Uno de los grandes retos al momento de realizar una extracción es identificar que fase o capa es cual. Después de agitar y dejar reposar se forman las dos fases, pero muchas veces se puede caer en la duda sobre si la capa superior o la inferior es la de interés. A continuación, se darán algunas reglas básicas que pueden ser de utilidad en esos momentos de incertidumbre.
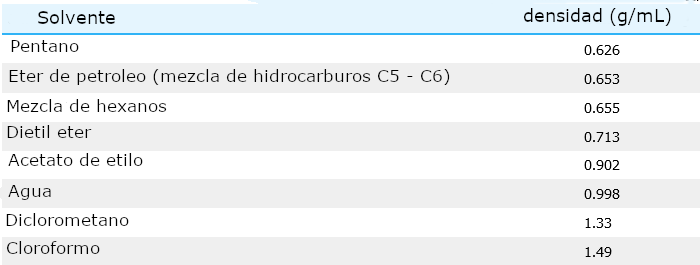
Densidad
Es esencial saber si la capa acuosa está por encima o por debajo de la capa orgánica en el embudo de separación, ya que esto dicta qué capa se mantiene y cuál se desecha finalmente. Dos disolventes inmiscibles se apilarán uno encima del otro basándose en las diferencias de densidad. La solución de menor densidad se colocará en la parte superior, y la solución más densa se colocará en la parte inferior.
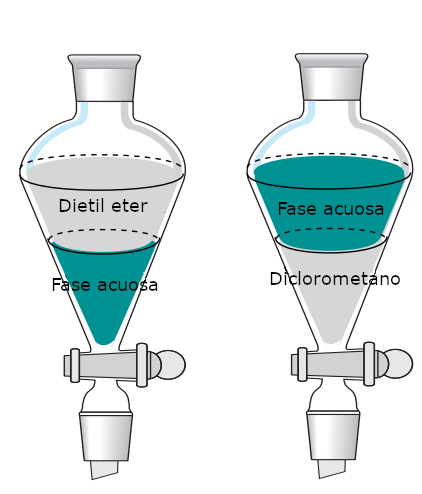
La mayoría de los disolventes orgánicos no halogenados tienen densidades inferiores a 1g/mL por lo que flotarán sobre una solución acuosa (si son inmiscibles). Una excepción notable es que los disolventes halogenados son más densos que el agua (tienen densidades > 1g/mL), por lo que se hundirán por debajo de las soluciones acuosas (Tabla 1 y Figura 1).
Muchas de las soluciones utilizadas en los embudos de separación son bastante diluidas, por lo que la densidad de la solución es aproximadamente la misma que la del disolvente. Por ejemplo, si se mezclan éter dietílico y una solución de NaOH(aq) al 10% en un embudo de separación, no es necesario conocer la densidad exacta de la solución de NaOH al 10%.
Una solución al 10% de NaOH(aq) está compuesta por un 90% de agua (en masa), lo que significa que la densidad debería estar bastante cerca de la densidad del agua (aproximadamente 1g/mL). La densidad real de una solución de NaOH(aq) al 10% es de 1,1089g/mL un valor sólo ligeramente superior a la densidad del agua. El éter dietílico será la capa superior en esta situación.
Sin embargo, hay ocasiones en las que se disuelven tantas partículas de soluto que la densidad de la solución es mucho mayor que la del disolvente. Por ejemplo, una solución saturada de NaCl(aq) saturada tiene una densidad de alrededor de 1,2 g/mL (significativamente mayor que la densidad del agua), y puede causar problemas de separación con disolventes de densidades similares como el diclorometano.
Cómo determinar la capa acuosa
Las densidades de los disolventes pueden utilizarse para predecir qué capa es orgánica y cuál es acuosa en un embudo de separación, pero hay otros métodos que pueden ser útiles para esta determinación. Si no está seguro de qué capa es acuosa y qué capa es orgánica, haga una de las siguientes cosas:
- Añade un poco de agua de una botella de chorro al embudo de separación (Figura 2a) y observa a dónde van las gotas de agua.
Si la capa superior es acuosa, las gotas de agua se mezclarán con la capa superior y parecerá que desaparecen. Si la capa inferior es acuosa, las gotas de agua caerán a través de la capa superior para mezclarse con la capa inferior (como se indica con una flecha en la Figura 2b+c). Si es difícil seguir la pista de adónde van las gotas de agua, también hay que seguir el volumen de las capas: la capa que aumente con la adición de agua es la capa acuosa.

- Considere los volúmenes relativos de los disolventes acuosos y orgánicos, basándose en las cantidades utilizadas en el experimento.
La figura 3a muestra un embudo de separación de 125mL que contiene 10mL de hexano y 100mL de agua (teñida de azul). Si estas fueran las cantidades utilizadas en un experimento, la fase acuosa tendría que ser la capa inferior, ya que es mucho mayor. Aunque en este caso es inequívoco, es importante saber que la forma extraña del embudo de separación puede hacer que se juzguen mal los volúmenes. En la figura 3b se muestra un embudo de separación con volúmenes iguales de capas acuosas y orgánicas, aunque las capas se elevan a diferentes alturas en el embudo.

Para más información Which Layer is Which?
Como citar este artículo:
APA: (2021-09-22). Capa orgánica y capa acuosa. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/capa-organica-y-capa-acuosa/
ACS: . Capa orgánica y capa acuosa. https://quimicafacil.net/tecnicas-de-laboratorio/capa-organica-y-capa-acuosa/. Fecha de consulta 2024-07-26.
IEEE: , "Capa orgánica y capa acuosa," https://quimicafacil.net/tecnicas-de-laboratorio/capa-organica-y-capa-acuosa/, fecha de consulta 2024-07-26.
Vancouver: . Capa orgánica y capa acuosa. [Internet]. 2021-09-22 [citado 2024-07-26]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/capa-organica-y-capa-acuosa/.
MLA: . "Capa orgánica y capa acuosa." https://quimicafacil.net/tecnicas-de-laboratorio/capa-organica-y-capa-acuosa/. 2021-09-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net