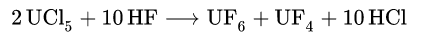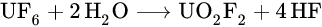Actualizado en agosto 26, 2022
Tiempo de lectura estimado: 16 minutos
El hexafluoruro de uranio (UF6), conocido coloquialmente como «hex» en la industria nuclear, es un compuesto utilizado en el proceso de enriquecimiento del uranio, que produce combustible para reactores y armas nucleares.
El hex forma cristales grises sólidos a temperatura y presión estándar, es altamente tóxico, reacciona con el agua y es corrosivo para la mayoría de los metales. El compuesto reacciona ligeramente con el aluminio, formando una fina capa superficial de AlF3 que resiste cualquier otra reacción del compuesto.
Historia del hexafluoruro de uranio
La primera síntesis de hexafluoruro de uranio fue realizada por Otto Ruff y Alfred Heinzelmann en la Universidad Técnica de Danzig y se presentó para su publicación el 15 de enero de 1909. Esta síntesis se llevó a cabo en un tubo de platino a -20 °C en ausencia de humedad, haciendo reaccionar el cloruro de uranio (V) con flúor:
En el curso de la disertación completa de Alfred Heinzelmann con fecha de publicación del 27 de junio de 1911, Ruff y Heinzelmann presentaron una revisión inicial del hexafluoruro de uranio al Zeitschrift für anorganische Chemie el 25 de junio de 1911. Además de la síntesis presentada anteriormente, se presentaron otras dos variantes y se describieron algunas propiedades y reacciones.
La reacción del cloruro de uranio (V) con el fluoruro de hidrógeno (HF) no es adecuada para la preparación de UF6 puro, ya que es difícil de separar del HF.
Cuando se permite que el uranio metálico o el dicarburo de uranio (UC2) reaccione con el flúor (en presencia de pequeñas cantidades de cloro como catalizador), se observa una conversión completa a UF6.
Ya en 1880, Alfred Ditte describió la reacción de un óxido de uranio verde (U3O4) con un exceso de ácido fluorhídrico concentrado, parte del cual producía un líquido amarillo que se evaporaba al calentarse y precipitaba en forma de cristales transparentes amarillos con la fórmula U2Fl2,4HFl.

También describió un «oxifluoruro» (U2OFl2), que es altamente volátil; al contacto con el oxígeno atmosférico, la «nieve blanca» se descompone en una sustancia negra. Estos resultados fueron reeditados a mayor escala en 1884. Estas afirmaciones resultaron más tarde ser erróneas.
Durante mucho tiempo, el hexafluoruro de uranio siguió siendo de interés sólo para los estudios de laboratorio. No fue hasta el descubrimiento de la fisión nuclear en 1938 que este compuesto adquirió mayor importancia, ya que es el único compuesto de uranio claramente volátil y a la vez estable. En 1941, Aristid von Grosse resumió las propiedades previamente conocidas y también describió el comportamiento químico hacia las sustancias inorgánicas y orgánicas, así como en los recipientes de vidrio en presencia de impurezas. La presión de vapor y el punto triple fueron medidos por Bernard Weinstock y Ray Crist. El trabajo se completó el 9 de febrero de 1942. El manuscrito preparado en 1943 se publicó en 1947 y se publicó en 1948. Isidor Kirshenbaum resumió sus propiedades físicas en 1943.
Síntesis
El hexafluoruro de uranio puede en principio prepararse a partir del uranio metálico, así como prácticamente todos los compuestos de uranio por reacción con el flúor elemental, así como con clorofluoruros y bromofluoruros.
Se puede dividir los métodos de formación en:
Elaboración de compuestos de uranio (VI) sin cambiar el estado de oxidación, por ejemplo, la rehalogenación del cloruro de uranio (VI) (UCl6), la fluoración del fluoruro de uranilo (UO2F2) y la descomposición térmica del UOF4, UO2F2 o de los fluorouranatos(VI).
Preparación a partir de uranio o de compuestos de uranio con estados de oxidación más bajos, por ejemplo, la fluoración oxidante del uranio metálico, del cloruro de uranio (V) (UCl5), de los diversos óxidos de uranio, carburos de uranio y fluoruros de uranio.
El uso de otros agentes fluorantes como los compuestos interhalógenos y los fluoruros de gases nobles.
Método estándar
El método común para la preparación del hexafluoruro de uranio es la reacción del fluoruro de uranio (IV) (UF4) con el flúor elemental (F2). La reacción tiene lugar a temperaturas superiores a 250 °C y se suele llevar a cabo a 300 °C; la reacción es endotérmica:
Si se usa el flúor con un exceso de aproximadamente el 50%, la reacción procede completamente. Este proceso también se utiliza técnicamente. El flúor se obtiene del proceso anódico de la electrólisis de una mezcla de fluoruro de potasio y fluoruro de hidrógeno.
De la misma manera, el hexafluoruro de neptunio (NpF6) se produce a 500 °C a partir del tetrafluoruro de neptunio (NpF4) y F2, y el hexafluoruro de plutonio (PuF6) se produce a 750 °C a partir del tetrafluoruro de plutonio (PuF4) y F2.
Con otros compuestos de flúor
Todos los óxidos de uranio reaccionan con el trifluoruro de cloro (ClF3), el trifluoruro de bromo (BrF3) y el pentafluoruro de bromo (BrF5) para formar UF6. La reactividad de los fluoruros halógenos es mayor que la del flúor elemental. El UO2 reacciona con el BrF3 a unos 50 °C, mientras que la reacción con el flúor no se produce hasta unos 400 °C. Los halofluoruros reaccionan violentamente con el uranio metálico; la reacción con el vapor de BrF3 puede provocar una explosión. El UO2 reacciona con el uranio metálico para formar UF6.
El UF4 también reacciona con fluoruros de gases nobles como el difluoruro de xenón (XeF2) a mayores temperaturas bajo presión o en HF líquido para formar UF6.
El trifluoruro de nitrógeno (NF3) fluye el uranio metálico, UO2, UF4, UO3, U3O8, y UO2F2 – 2H2O a temperaturas entre 100 y 550 °C para formar el UF6. Por lo tanto, el NF3 se considera un posible sustituto de los anteriores agentes fluorados en el ciclo de combustible nuclear existente, así como en el reprocesamiento de los compuestos actínidos volátiles.
Propiedades del hexafluoruro de uranio
Propiedades físicas
El hexafluoruro de uranio forma cristales incoloros que subliman a 56,54 °C a presión normal (1.013,25 hPa), es decir, pasan directamente del estado sólido al gaseoso.
Puede almacenarse indefinidamente a temperatura ambiente en ampollas de cuarzo o de pirex, siempre que no haya rastros de humedad, que el propio vidrio esté libre de toda inclusión de gas y que se haya eliminado completamente todo el fluoruro de hidrógeno (HF) presente.
El punto triple, en el que las tres fases -sólido, líquido y gas- están en equilibrio, se encuentra a una temperatura de 64,05 °C y una presión de 1133±7 mmHg (aprox. 1510 hPa). Sólo por encima de esta presión es posible una fase líquida también.
El punto crítico por encima del cual el líquido y el gas ya no pueden distinguirse entre sí se encuentra a una temperatura (Tc) de 230,2 °C, una presión (pc) de 45,5 atm (46,1 bar), un volumen molar (Vm, c) de 256,0 cm3-mol-1, y una densidad (ρc) de 1,375 g-cm-3. La presión de vapor a 25 °C es de 153 mbar (153 hPa).
La volatilidad del UF6 es similar a la del hexafluoruro de neptunio (NpF6) y el hexafluoruro de plutonio (PuF6); juntos se encuentran entre los tres hexafluoruros de elementos actínidos conocidos hasta la fecha.
La entropía de formación (S0m) para el UF6 sólido es: -430,4 ± 1,5 J-K-1-mol-1, para el UF6 gaseoso: -280,4 ± 1,5 J-K-1-mol-1. La entalpía de sublimación (ΔHs) en el punto de sublimación (56,54 °C) es de 48,23 kJ-mol-1; la entalpía de vaporización (ΔHv) en el punto triple (64,05 °C) es de 28,76 kJ-mol-1.
El hexafluoruro de uranio es paramagnético; la susceptibilidad magnética molar χmol es de 43-10-6 cm3-mol-1.
Estructura cristalina y molecular del hexafluoruro de uranio
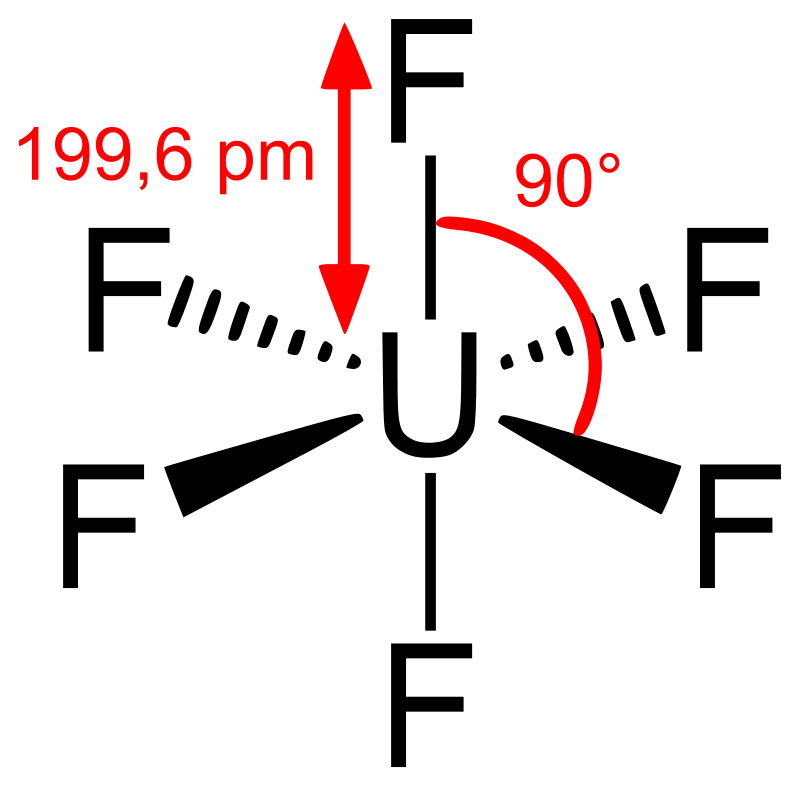
El hexafluoruro de uranio es un compuesto covalente y no una sal. La molécula de UF6 es octaédrica (Oh); en el estado gaseoso, la longitud del enlace U-F es de 199,6 pm.
La longitud y el ángulo de unión del hexafluoruro de uranio gaseoso
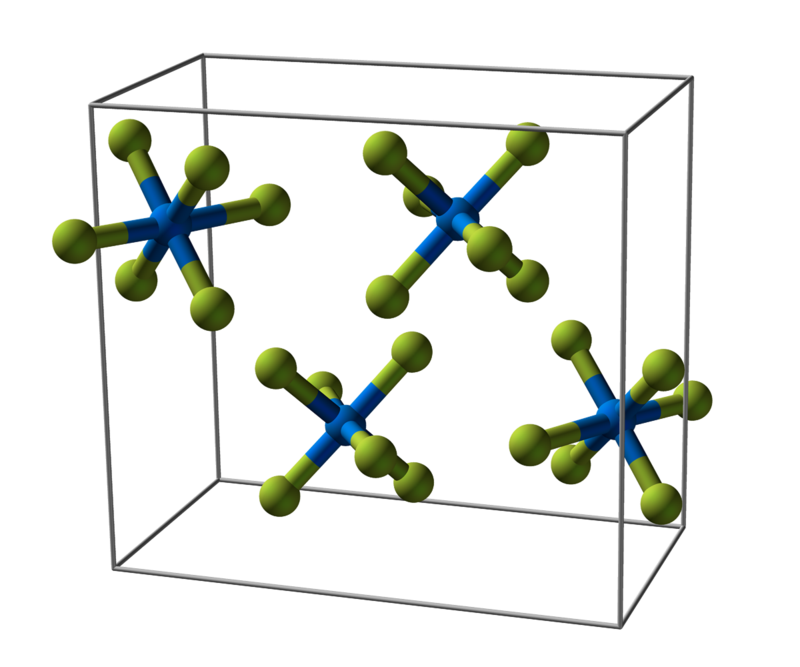
El hexafluoruro de uranio se cristaliza en el sistema cristalino ortorrómbico a 293 K (20 °C) en el grupo espacial Pnma (No. 62) con parámetros de red a = 990,0 pm, b = 896,2 pm, y c = 520,7 pm con cuatro unidades de fórmula por unidad de celda. En el cristal, las moléculas muestran una ligera desviación de la coordinación octaédrica regular. A 293 K (20 °C), las desviaciones medidas de los movimientos libracionales de los átomos de flúor son +1,5 pm para las distancias U-F y +2,0 pm para las distancias F-F. Las distancias corregidas son 199,2-200,4 pm para U-F, 280,4-282,6 pm para F-F, y el ángulo F-U-F es 89,42(17)-90,20(11)°.
Al enfriarse a 193 K (-80 °C), los parámetros de la red disminuyen a a = 984,3 pm, b = 892,0 pm, y c = 517,3 pm. El empaquetamiento de la esfera hexagonal tiende a volverse más regular, y las distancias F-F fuera de un octaedro UF6 se acortan. Las octaedras de las moléculas son casi regulares con una distancia media U-F de 198 pm, una longitud media del borde F-F de 280 pm, y un ángulo F-U-F de 90,0° a 193 K. Las octaedras de la octava UF6 son casi regulares.
Al enfriarse aún más a 77 K (-196 °C), las longitudes de los enlaces metal-flúor no disminuyen significativamente, pero las coordenadas atómicas siguen acercándose a las coordenadas ideales de la empaquetadura de la esfera hexagonal de los átomos de flúor.
Propiedades químicas
El hexafluoruro de uranio es estable en aire seco. Sin embargo, reacciona muy violentamente con el agua (ya por la humedad atmosférica), formando el fluoruro de uranilo soluble en agua (UO2F2) y el fluoruro de hidrógeno (HF). El HF forma ácido fluorhídrico fuertemente corrosivo en el exceso de agua.
El UF6 es un poderoso agente fluorizante y oxidante. Reacciona con la mayoría de los metales y aleaciones (por ejemplo, hierro, aleaciones de aluminio y magnesio, aceros inoxidables) para formar fluoruros metálicos, muy lentamente a temperatura ambiente y algo más rápidamente a temperaturas elevadas.
Como los fluoruros que se forman son muy volátiles, forman depósitos en las superficies afectadas que pueden impedir una reacción posterior. El níquel, en particular, es químicamente muy resistente. Los polímeros sintéticos de alta calidad, como el teflón y algunos copolímeros, también muestran una buena resistencia al UF6.
Por otra parte, los compuestos orgánicos reaccionan con el UF6 ya a temperatura ambiente mediante la fluoración; en el proceso, el HF y el UF4 se forman con la deposición del carbono. Los compuestos orgánicos que contienen oxígeno, como el etanol o el éter dietílico, reaccionan rápidamente con la deposición de fluoruro de uranilo y la formación de HF.
Usos del hexafluoruro de uranio
El hexafluoruro de uranio se utiliza para la separación de isótopos de uranio por el método de difusión de gas o por medio de ultracentrífugas de gas. Es ideal para este propósito porque, a diferencia de la mayoría de los demás compuestos de uranio, puede convertirse fácilmente en fase gaseosa y porque el flúor es un elemento puro: sólo existe un isótopo de flúor (19F) en la naturaleza; todos los átomos de flúor naturales tienen exactamente la misma masa atómica.
Por lo tanto, las diferencias de masa de las moléculas de hexafluoruro de uranio explotadas en la separación de isótopos son -como se desea- sólo debidas a las diferencias de masa de los isótopos de uranio 238U y 235U. El hexafluoruro de uranio es, por lo tanto, un componente del ciclo de combustible nuclear. Para su uso posterior en reactores de agua a presión y en ebullición, el hexafluoruro de uranio enriquecido se transporta a fábricas de elementos combustibles, donde primero se procesa en dióxido de uranio y finalmente en elementos combustibles.
Para el reprocesamiento de los elementos combustibles gastados, se ha propuesto separar el uranio (95 % de la masa total) triturando finamente el material y tratándolo con flúor elemental («fluoración directa»). Los fluoruros volátiles resultantes (principalmente UF6 y pequeñas cantidades de NpF6) se separan fácilmente de los fluoruros no volátiles, por ejemplo, el fluoruro de plutonio (IV) (PuF4), el fluoruro de americio (III) (AmF3), el fluoruro de curio (III) (CmF3) y los fluoruros de la mayoría de los productos de fisión. El hexafluoruro de neptunio (NpF6) y el hexafluoruro de plutonio (PuF6) son sensibles a la luz ultravioleta y se descomponen con los tetrafluoruros y el flúor, por lo que pueden ser eliminados fotoquímicamente de una mezcla con UF6.
Transporte y almacenamiento
Dado que los lugares de producción, separación de isótopos y procesamiento ulterior se encuentran en lugares diferentes, se requiere el transporte y almacenamiento del hexafluoruro de uranio. El transporte se realiza por carretera, ferrocarril o barco. Para ello se dispone de tanques especiales que deben cumplir con las normas ANSI N14.1 o ISO 7195. Los tanques de acero de los tipos 48 F o 48 Y son los más comunes. Tienen un diámetro de 48 pulgadas (unos 122 cm), un grosor de pared de 16 mm y pueden soportar hasta 12,5 toneladas. Para el transporte de hexafluoruro de uranio enriquecido se utilizan tanques más pequeños de tipo 30 B. Tienen un diámetro de 30 pulgadas (unos 76 cm) y una capacidad de 2.277 toneladas. La Ordenanza de Mercancías Peligrosas para Carreteras, Ferrocarriles y Vías Navegables (GGVSEB) contiene un reglamento sobre este tema para aprobar el diseño de embalajes para el hexafluoruro de uranio no fisionable o fisionable exento.
Los transportes están regulados por el OIEA. Sin embargo, son controvertidos y han dado lugar, entre otras cosas, a varias investigaciones en el Bundestag alemán y en el Landtag de Baden-Württemberg. Estos transportes están en el debate público, especialmente después de que se produjera un incendio en el carguero Atlantic Cartier que transportaba hexafluoruro de uranio en el puerto de Hamburgo el 1º de mayo de 2013 y de que hubiera considerables dificultades para extinguirlo.
En los Estados Unidos, en 2000 se almacenaron al menos 46.422 tambores de hexafluoruro de uranio en al menos tres lugares: 4.683 tambores en el emplazamiento de la antigua planta de enriquecimiento de uranio llamada K-25 en Oak Ridge, en el Estado de Tennessee, 28.351 en la planta de enriquecimiento de uranio de Paducah, en Kentucky, y 13.388 en la planta de enriquecimiento de uranio de Portsmouth, en Ohio.
Ha habido varios accidentes relacionados con el hexafluoruro de uranio en los Estados Unidos. Una ocurrió en 1986 en una planta de la Sequoyah Fuels Corporation cerca de Gore, Oklahoma. Cuando un tanque sobrellenado se calentó para eliminar el material derramado, el tanque se rompió.
Efectos fisiológicos y precauciones de seguridad
El hexafluoruro de uranio afecta al cuerpo humano de tres maneras principales:
Es una sustancia muy agresiva que ataca cualquier tejido. Cuando el gas entra en contacto con los fluidos corporales, se forma ácido fluorhídrico que causa quemaduras en la piel y las membranas mucosas del tracto respiratorio. La exposición de los seres humanos al gas afecta inicialmente a los ojos y al tracto respiratorio, causando irritación, pérdida de visión, tos y producción excesiva de saliva y esputo. Después de una exposición prolongada, esto conduce a la neumonitis y al edema pulmonar y puede resultar en la muerte.
Como todos los compuestos de uranio hexavalente, es muy tóxico si se inhala o se ingiere. También existe el riesgo de que se acumule en el cuerpo humano, afectando en particular al hígado y los riñones.
Como todos los compuestos de uranio, es radioactivo. La actividad depende de la composición isotópica del uranio. El 238U tiene una vida media de 4.468 millones de años y como los otros isótopos naturales (234U y 235U) es un emisor α. La actividad específica de 238U es de 12,35 Bq/mg. El 235U tiene una vida media de 704 millones de años. Es fisionable y representa alrededor del 0,7% en los depósitos de uranio natural. El hexafluoruro de uranio enriquecido es mucho más activo debido a su menor vida media.
Para más información Uranium hexafluoride
Como citar este artículo:
APA: (2021-09-21). Hexafluoruro de uranio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-uranio/
ACS: . Hexafluoruro de uranio. https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-uranio/. Fecha de consulta 2024-07-27.
IEEE: , "Hexafluoruro de uranio," https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-uranio/, fecha de consulta 2024-07-27.
Vancouver: . Hexafluoruro de uranio. [Internet]. 2021-09-21 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-uranio/.
MLA: . "Hexafluoruro de uranio." https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-uranio/. 2021-09-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net