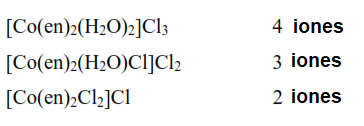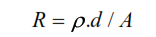Tiempo de lectura estimado: 8 minutos
En los compuestos iónicos de los elementos del grupo principal, suele ser una cuestión trivial deducir el número de iones por mol presentes en una solución infinitamente diluida. Se considera que los compuestos iónicos se disocian completamente en la solución diluida (aunque a medida que aumenta la concentración de soluto, el grado de ionización cambia drásticamente), y así se esperaría que el Ca(NO3)2 estuviera formado por tres iones: un ion Ca2+ y dos iones nitrato (NO3–).
En los complejos de metales de transición, la situación no es tan sencilla. Un determinado anión puede formar parte del complejo (en cuyo caso generalmente no se disocia) o puede estar presente como contraión (en cuyo caso sí lo hace). Werner, en 1912, investigó el complejo octaédrico Co(en)2Cl3 (en = etilendiamina) que tiene tres disposiciones potenciales diferentes de los ligandos en solución acuosa:
No hay forma de saber de antemano cuál de las fórmulas anteriores es la correcta. (La situación se complica aún más en el sentido de que la actividad óptica también es posible en el caso anterior). El número de iones que constituyen el complejo se determina mejor midiendo la conductividad de la solución de ese compuesto. Esta medición de la conductividad permite saber cuántos iones (cationes y aniones) están presentes en la solución cuando un producto iónico se disuelve en agua.
Electrolitos y conductividad
Los compuestos iónicos que son solubles en agua y conducen la corriente eléctrica en solución acuosa se denominan electrolitos. El proceso de disolución consiste en la disociación completa de los compuestos iónicos en cationes y aniones móviles. Hay muchos compuestos que, aunque son solubles en agua, no presentan ninguna conductividad. Se denominan no electrolitos.
Hay otro grupo de compuestos que presentan conductividad en soluciones sólo cuando la solución es bastante diluida. Estos compuestos se denominan electrolitos débiles. Las soluciones que contienen un gran número de iones móviles (cationes y aniones de los compuestos iónicos solubles) conducen bien la corriente, y las soluciones que contienen sólo unos pocos iones (ácido acético) o iones relativamente inmóviles muestran una mala conductividad.
La conductividad de una solución varía con el número, el tamaño y la carga de los iones que la constituyen. La viscosidad de una solución también influye en la conductividad, al afectar a la movilidad de los iones. Por lo tanto, los iones de diferentes especies en solución mostrarán conductividades diferentes. Si, mediante una reacción química, sustituimos una especie iónica por otra que tenga un tamaño y/o una carga diferentes, observaremos un cambio correspondiente en la conductividad de la solución resultante.
La conductividad, L, de una solución se representa mediante la ecuación
donde B es una constante que depende del tamaño y la geometría de la célula de conductancia, ci. es la concentración de los iones individuales en la solución, αi, es la conductancia iónica equivalente de los iones individuales, y ZI. es la carga de los iones.
En la práctica, aunque la conductancia de una solución es más útil cuando se trata de soluciones electrolíticas, lo que se mide experimentalmente es la resistencia de una solución. La conductancia se calcula a partir de la resistencia. La resistencia de una solución se determina introduciendo dos electrodos en una solución. La resistencia, R, es proporcional a la distancia, d, entre los dos electrodos e inversamente proporcional al área de la sección transversal A, de la solución encerrada entre los electrodos.
El término ρ se denomina resistencia específica o, más sencillamente, resistividad. La relación d/A se suele denominar constante de célula, K. Así, la relación anterior se convierte en
La conductancia, L, de una solución se define como el recíproco de la resistencia específica.
En la práctica, la constante de la celda, K, se determina para cualquier celda midiendo la conductividad de una solución de KCl 0,0200M a 25 °C, para la cual la conductividad específica, k, es de 0,002 768 ohm-1.
La conductividad total de una solución proviene de varias fuentes, la mayor de las cuales son los iones. La autoionización de un disolvente también contribuye, pero en la práctica es lo suficientemente pequeña como para ser despreciada en todas las mediciones, excepto en las más cuidadosas.
Una magnitud muy útil es la conductividad equivalente, Λ. Se define como el valor de la conductividad específica, k, aportada por un equivalente de iones de cualquier carga. Más concretamente, se define como la conductancia de una solución que contiene un gramo-equivalente de un electrolito colocado entre electrodos separados por una distancia de 1 cm. Si c es la concentración de la solución en gramos-equivalentes por litro, el volumen de la solución en centímetros cúbicos por equivalente (cm3/equiv) es igual a 1000/c. La conductancia equivalente. Λ, viene dada entonces por.
Sustituyendo por k,
Otra cantidad frecuentemente utilizada en las mediciones de conductancia es la conductancia molar, ∧m. Se define como la conductancia de un volumen de solución de un centímetro cúbico que contiene un mol (o peso de la fórmula) del electrolito. Si M es la concentración de la solución en moles por litro, entonces el volumen en centímetros cúbicos por mol es 1000/M. La conductancia molar viene dada entonces por
Comparando la conductancia molar medida para un compuesto particular con la de un compuesto iónico conocido, podemos estimar el número de iones producidos en una solución. A continuación, se presenta un rango de valores de conductancia molar para 2-5 iones a 25 °C en agua.
Materiales
Reactivos
Procedimiento
Determinación de la constante K
Las mediciones de conductividad requieren el uso de dos instrumentos: la célula de conductividad y el conductímetro o puente. La constante de la celda, K, se determina primero midiendo la conductividad, L, de una solución de KCl 0,0200M preparada con precisión para la que se sabe que el valor de la conductividad específica, k, es de 0,002768 ohm-1.
Uso de la celda para determinar el numero de iones de un compuesto desconocido de interes
La conductividad molar de cualquier compuesto se determina de la siguiente manera.
Se prepara una solución 1×10-3 M del compuesto de interés. (se puede utilizar sales dipróticas o tripróticas)
La conductividad se mide en la misma celda para la que se ha determinado previamente la constante de la celda previamente determinada, como se ha descrito anteriormente.
La celda debe ser enjuagada antes de cada medición.
Realizar las mediciones tanto para la solución de calibración como de la solución del compuesto de interés por triplicado.
Después del laboratorio
Empleando los datos de conductimetría obtenidos con la solución de cloruro de potasio, determinar la constante K de la celda tomando el valor medio de las mediciones de conducción.
Empleando el valor de K calculado para la celda, determinar el número de iones según la conductividad medida del compuesto de interés propuesto.
Para más información Conductance of Solutions
Como citar este artículo:
APA: (2022-11-30). Estandarización de una celda de conductimetría. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-inorganica/estandarizacion-de-una-celda-de-conductimetria/
ACS: . Estandarización de una celda de conductimetría. https://quimicafacil.net/manual-de-laboratorio/q-inorganica/estandarizacion-de-una-celda-de-conductimetria/. Fecha de consulta 2024-07-27.
IEEE: , "Estandarización de una celda de conductimetría," https://quimicafacil.net/manual-de-laboratorio/q-inorganica/estandarizacion-de-una-celda-de-conductimetria/, fecha de consulta 2024-07-27.
Vancouver: . Estandarización de una celda de conductimetría. [Internet]. 2022-11-30 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-inorganica/estandarizacion-de-una-celda-de-conductimetria/.
MLA: . "Estandarización de una celda de conductimetría." https://quimicafacil.net/manual-de-laboratorio/q-inorganica/estandarizacion-de-una-celda-de-conductimetria/. 2022-11-30. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net