Actualizado en enero 10, 2024
Tiempo de lectura estimado: 7 minutos
«Extracción» se refiere a la transferencia de compuestos de un sólido o líquido a un disolvente o fase diferente. En el laboratorio de química, lo más habitual es utilizar la extracción líquido-líquido, un proceso que tiene lugar en un embudo de separación. Se coloca en el embudo una solución que contiene componentes disueltos y se añade un disolvente inmiscible, lo que da lugar a dos capas que se agitan juntas. Lo más habitual es que una capa sea acuosa y la otra un disolvente orgánico. Los componentes se «extraen» cuando pasan de una capa a la otra.
En el laboratorio de química, lo más habitual es utilizar la extracción líquido-líquido, un proceso que tiene lugar en un embudo de separación (figura 1). En el embudo se coloca una solución que contiene componentes disueltos y se añade un disolvente inmiscible, lo que da lugar a dos capas que se agitan juntas. Lo más habitual es que una capa sea acuosa y la otra un disolvente orgánico. Los componentes se «extraen» cuando pasan de una capa a la otra. La forma del embudo de separación permite un drenaje y una separación eficaces de las dos capas.

Los compuestos pasan de un líquido a otro en función de su solubilidad relativa en cada uno de ellos. Una guía rápida para la solubilidad es el principio de «lo que se disuelve es lo mismo», lo que significa que los compuestos no polares deberían extraerse fácilmente en disolventes no polares (y viceversa). Los compuestos responsables del sabor y el color del té deben ser polares si se extraen fácilmente en agua caliente. Cuando se deja equilibrar entre dos líquidos en un embudo de separación, la mayor parte de un compuesto suele acabar en la capa que es más soluble.
Usos de la extracción en el laboratorio de química
Hay varias razones para utilizar la extracción en el laboratorio de química. Es un método principal para aislar compuestos de materiales vegetales. La extracción traslada los compuestos de un líquido a otro, para que puedan ser manipulados o concentrados más fácilmente. También permite la eliminación selectiva de los componentes de una mezcla.
Extracción de compuestos naturales
Las frutas y las hojas de las plantas están compuestas principalmente por celulosa y agua, pero también contienen «aceites esenciales», una mezcla grasa de compuestos que captan la «esencia» del olor y el sabor del material vegetal. El aceite de naranja tiene aproximadamente un 95% de
limoneno (Figura 2b), y debido a su estructura no polar, puede extraerse de su corteza en un disolvente orgánico como hexanos o diclorometano (Figura 2a). El aceite puede concentrarse y utilizarse para aromatizar o perfumar alimentos, productos de limpieza y velas.

En el laboratorio de química, los aceites esenciales suelen extraerse de su fuente mediante disolventes y se analizan mediante cromatografía de gases o espectroscopia.
Extracción de compuestos a partir de emulsiones o soluciones
Otro método de extracción de aceites esenciales de materiales vegetales fragantes es la destilación al vapor (Figura 3b). Este proceso suele dar lugar a que los compuestos de olor agradable queden suspendidos en el destilado acuoso (Figura 3c). Para concentrar el aceite, la suspensión acuosa suele extraerse con un disolvente orgánico de bajo punto de ebullición (Figura 3d), que luego puede extraerse fácilmente del aceite.

Eliminación selectiva de componentes
Cuando se realiza un experimento que sintetiza un producto químico, la reacción suele estar completa cuando se deja de agitar o calentar. Sin embargo, ¡siempre hay más pasos en el procedimiento! Lo que suele ocurrir inmediatamente después es «trabajar» la reacción de alguna manera. Un trabajo se refiere a los métodos destinados a aislar el producto de la mezcla de reacción, y a menudo comienza utilizando un embudo de separación y extracciones.
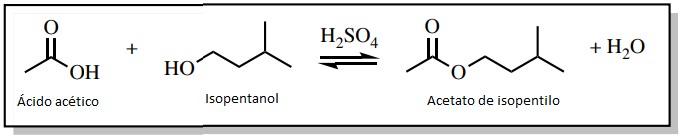
Por ejemplo, imagine que el ácido acético y el isopentanol se han calentado en presencia de un catalizador ácido durante una hora (figura 4) para producir acetato de isopentilo, un éster que huele a plátano (véase el esquema de reacción en la figura 5). Tras el periodo de una hora, desgraciadamente no sólo hay el éster que huele a plátano en el matraz. El matraz también contendrá subproductos (el agua en este caso), restos de materiales de partida si la reacción es incompleta, así como cualquier catalizador utilizado (H2SO4 en este caso). En este ejemplo, ¡podría haber cinco compuestos en el matraz de reacción una vez que haya cesado el calentamiento (Figura 6)!
Cuando se «trabaja» esta reacción, la mezcla resultante se suele verter en un embudo de separación junto con algo de agua y disolvente orgánico. Esto produce dos capas en el embudo de separación: una capa acuosa y una capa orgánica.
Tras agitar esta mezcla heterogénea, los compuestos se distribuyen en función de su solubilidad. Los compuestos que tienen una alta solubilidad en agua favorecen la capa acuosa, mientras que los compuestos menos polares favorecen la capa orgánica. En este ejemplo, el catalizador ácido y el ácido carboxílico residual o el alcohol probablemente serían arrastrados a la capa acuosa. El éster tendría una mayor afinidad por la capa orgánica que por la acuosa, lo que provocaría su aislamiento de los demás componentes de la mezcla de reacción (Figura 6).

En este ejemplo, es posible que también se arrastren pequeñas cantidades de alcohol a la capa orgánica, pero probablemente podrían eliminarse con un «lavado» con agua. En un lavado, el compuesto deseado (por ejemplo, el acetato de isopentilo), permanece en su capa actual del embudo de separación (en este ejemplo, la capa orgánica), y los compuestos no deseados se eliminan, o son «lavados» hacia otra capa (por ejemplo, la capa acuosa). Un lavado es diferente a una extracción, porque en una extracción el compuesto deseado se mueve de su ubicación actual (es decir, se mueve de una capa acuosa a una capa orgánica), mientras que en el lavado el compuesto deseado permanece en su capa actual.
Para más información Uses of Extraction
Como citar este artículo:
APA: (2021-09-08). Introducción a la extracción. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-extraccion/
ACS: . Introducción a la extracción. https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-extraccion/. Fecha de consulta 2024-07-27.
IEEE: , "Introducción a la extracción," https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-extraccion/, fecha de consulta 2024-07-27.
Vancouver: . Introducción a la extracción. [Internet]. 2021-09-08 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-extraccion/.
MLA: . "Introducción a la extracción." https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-extraccion/. 2021-09-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net