Estimated reading time: 6 minutos
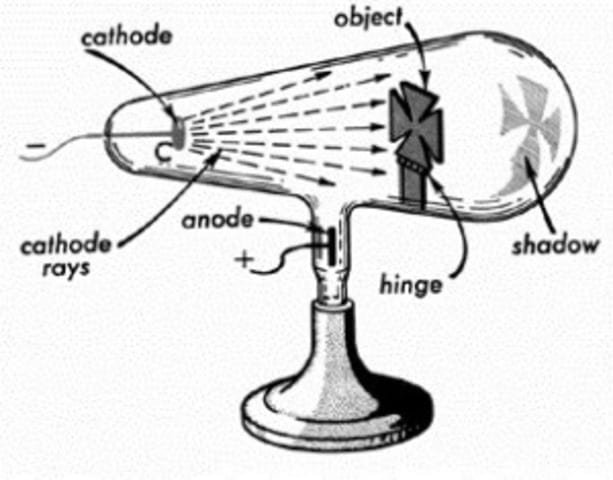
Sir William Crookes (17 de junio de 1832 – 4 de abril de 1919) fue un químico y físico británico que asistió al Royal College of Chemistry de Londres, y trabajó en la espectroscopia. Fue un pionero de los tubos de vacío, al inventar el tubo de Crookes, fabricado en 1875. Fue un descubrimiento fundamental que acabó cambiando toda la química y la física.
Se le atribuye el descubrimiento del elemento talio, anunciado en 1861, con la ayuda de la espectroscopia. También fue el primero en describir el espectro del helio terrestre, en 1865. Crookes fue el inventor del radiómetro Crookes, pero no llegó a discernir la verdadera explicación del fenómeno que detectó. Crookes también inventó una lente para gafas de sol que bloquea el 100% de los rayos ultravioleta. Durante un tiempo se interesó por el espiritismo y llegó a ser presidente de la Sociedad para la Investigación Psíquica.
Carrera científica de William Crookes
Después de estudiar en el Royal College of Chemistry, Londres, Crookes se convirtió en superintendente del departamento meteorológico del Observatorio Radcliffe, Oxford, en 1854, y al año siguiente obtuvo un puesto en el College of Science en Chester, Cheshire.
Habiendo heredado una gran fortuna de su padre, se dedicó por completo desde 1856 a trabajos científicos de diversos tipos en su laboratorio privado en Londres. Sus investigaciones sobre descargas eléctricas a través de un gas enrarecido lo llevaron a observar el espacio oscuro alrededor del cátodo, ahora llamado el espacio oscuro de Crookes.
Él demostró que los rayos catódicos viajan en líneas rectas y producen fosforescencia y calor cuando golpean ciertos materiales. Inventó muchos dispositivos para estudiar el comportamiento de los rayos catódicos, pero su teoría de la materia radiante, o un cuarto estado de la materia, resultó incorrecta en muchos aspectos.
Descubrimiento del talio
Con la introducción del análisis de espectro por R.W. Bunsen y G.R. Kirchhoff, Crookes aplicó la nueva técnica al estudio de los compuestos de selenio. En 1861 descubrió el talio en algunos depósitos seleníferos. Continuó trabajando en ese nuevo elemento, lo aisló, estudió sus propiedades y en 1873 determinó su peso atómico.
Durante sus estudios de talio, Crookes descubrió el principio del radiómetro Crookes, un dispositivo que convierte la radiación de luz en movimiento rotativo. El principio de este radiómetro ha encontrado numerosas aplicaciones en el desarrollo de instrumentos de medición sensibles. Crookes fue nombrado caballero en 1897.
En 1913, Crookes creó una lente que bloqueaba el 100% de la luz ultravioleta y 90% de la infrarroja hecha de vidrio que contenía cerio, pero solo ligeramente teñida. Fueron un subproducto no deseado de la investigación de Crookes para encontrar una formulación de vidrio para lentes que protegería a los trabajadores del vidrio de las cataratas.
Crookes probó más de 300 formulaciones, cada una numerada y etiquetada. El Crookes Glass 246 fue el tinte recomendado para los trabajadores del vidrio. Los tintes de Crookes más conocidos son A (retirado debido a su uranio), A1, B y B2, que absorben todo el ultravioleta por debajo de 350 nm mientras oscurecen la luz visual.
Crookes y el espiritismo
William Crookes se interesó por el espiritismo a finales de la década de 1860, y su participación más intensa tuvo lugar entre 1874 y 1875. Eric Deeson señala que los estudios de Crookes sobre lo oculto están relacionados con su trabajo científico sobre la radiometría en el sentido de que ambos implicaban la detección de fuerzas no descubiertas previamente.
Posiblemente, Crookes se vio influido por la muerte de su hermano menor, Philip, en 1867, a los 21 años, a causa de la fiebre amarilla contraída durante una expedición para tender un cable telegráfico de Cuba a Florida. En 1867, influenciado por Cromwell Fleetwood Varley, Crookes asistió a una sesión de espiritismo para intentar ponerse en contacto con su hermano.
Entre 1871 y 1874, Crookes estudió a las médiums Kate Fox, Florence Cook y Daniel Dunglas Home. Tras su investigación, creyó que los médiums podían producir auténticos fenómenos paranormales y comunicarse con los espíritus. Los psicólogos Leonard Zusne y Warren H. Jones han descrito a Crookes como crédulo, ya que avalaba a los médiums fraudulentos como auténticos.
En una serie de experimentos realizados en Londres, Inglaterra, en la casa de Crookes en febrero de 1875, la médium Anna Eva Fay consiguió engañar a Crookes haciéndole creer que tenía auténticos poderes psíquicos. Fay confesó más tarde su fraude y reveló los trucos que había utilizado. En relación con Crookes y sus experimentos con médiums, el mago Harry Houdini sugirió que Crookes había sido engañado. El físico Victor Stenger escribió que los experimentos estaban mal controlados y que «su deseo de creer le cegó ante las argucias de sus sujetos psíquicos.»
Crookes se unió a la Sociedad para la Investigación Psíquica, llegando a ser su presidente en la década de 1890: también se unió a la Sociedad Teosófica y al Club de los Fantasmas, del que fue presidente de 1907 a 1912. En 1890 fue iniciado en la Hermetic Order of the Golden Dawn.
Para más información Sir William Crookes | British chemist | Britannica
Como citar este artículo:
APA: (2019-06-17). Sir William Crookes. Recuperado de https://quimicafacil.net/infografias/biografias/sir-william-crookes/
ACS: . Sir William Crookes. https://quimicafacil.net/infografias/biografias/sir-william-crookes/. Fecha de consulta 2025-10-21.
IEEE: , "Sir William Crookes," https://quimicafacil.net/infografias/biografias/sir-william-crookes/, fecha de consulta 2025-10-21.
Vancouver: . Sir William Crookes. [Internet]. 2019-06-17 [citado 2025-10-21]. Disponible en: https://quimicafacil.net/infografias/biografias/sir-william-crookes/.
MLA: . "Sir William Crookes." https://quimicafacil.net/infografias/biografias/sir-william-crookes/. 2019-06-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net