Actualizado en enero 10, 2024
Las histrionicotoxinas son un grupo de toxinas relacionadas que se encuentran en la piel de ranas venenosas de la familia de los Dendrobatidae, en particular la Oophaga histrionica (antes Dendrobates histrionicus), que son originarias de Colombia.
En 1823, un viajero occidental llamado Capitán Charles Stuart Cochrane informó de sus expediciones por las selvas tropicales de las tierras bajas de Colombia. Se encontró con tribus de indios nativos que usaban flechas venenosas y dardos de cerbatana para la caza. Eventualmente, descubrió que el veneno había sido extraído de pequeñas ranas de colores brillantes. Uno de estos venenos se llama histrionicotoxina, llamado así por la subespecie de la que se extrae, Dendrobates histrionicus.
Cochrane escribió:
«llamada rana de veneno por los españoles, de unos tres centímetros de largo, amarilla en la espalda, con ojos negros muy grandes… los que usan su veneno atrapan las ranas en el bosque y las confinan en una caña hueca donde las alimentan regularmente hasta que quieren el veneno, cuando toman al desafortunado reptil y pasan un puntiagudo pedazo de madera por su garganta y por una de sus patas. Esta tortura hace que la pobre rana transpire mucho, sobre todo en la espalda, que se cubre de una espuma blanca; éste es el veneno más poderoso que produce, y en él sumergen o hacen rodar las puntas de sus flechas, que conservarán su poder destructivo durante un año. Después, debajo de esta sustancia blanca, aparece un aceite amarillo, que se raspa cuidadosamente, y conserva su influencia mortal durante cuatro a seis meses, según la bondad (como se dice) de la rana. De esta manera, de una rana se obtiene suficiente veneno para unas cincuenta flechas».
Charles Stuart Cochrane

Su hábitat va desde los bosques tropicales de las tierras bajas hasta las zonas montañosas áridas, y generalmente se limitan a América del Sur y Central. Algunas especies se encuentran junto a ríos y arroyos o en zonas húmedas y sombreadas, mientras que otras pasan su tiempo en los árboles o incluso en campo abierto y seco, siempre que haya suficiente humedad y refugio.
Características de las histrionicotoxinas
Es probable que, como ocurre con otros alcaloides de ranas venenosas, las histrionicotoxinas no sean fabricadas por los anfibios, sino que se absorban de los insectos en su dieta y se almacenen en las glándulas de su piel. Son notablemente menos tóxicas que otros alcaloides que se encuentran en las ranas venenosas, pero su estructura distintiva actúa como una neurotoxina por la inhibición no competitiva de los receptores nicotínicos de acetilcolina.
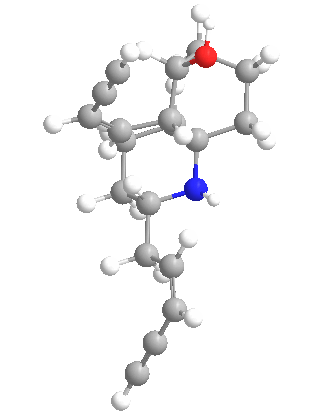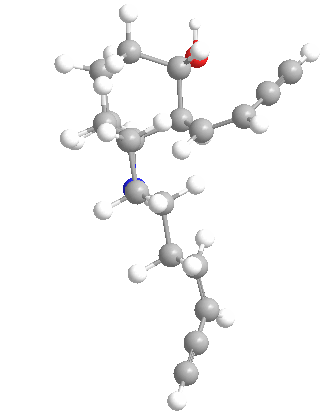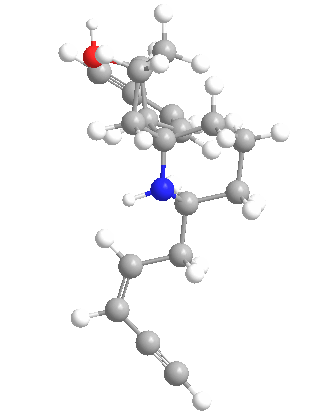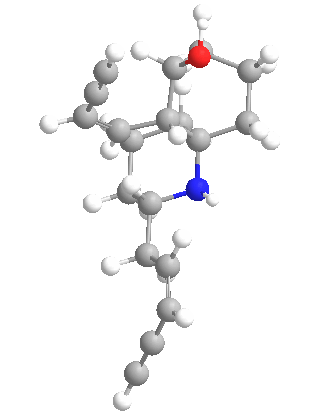
Química
Las histrionicotoxinas son una clase más que un veneno específico y este amplio espectro plantea desafíos sintéticos. Las estructuras de las histrionicotoxinas fueron caracterizadas en 1971. Desde entonces, se han realizado varios estudios sintéticos y síntesis totales. En la siguiente tabla se describen algunas de las muchas variaciones de los alcaloides de histrionicotoxinas de la molécula madre (283A).

Síntesis
Desde la caracterización, el desarrollo de vías sintéticas para la histrionicotoxina ha sido de interés para los grupos de investigación debido a su inusual funcionalidad. El grupo del profesor Yoshito Kishi en la universidad de Harvard propuso la primera síntesis total del progenitor 283A en 1985 utilizando 89, un lactámico previamente sintetizado que se utilizó para la síntesis de otras variantes.
El tratamiento con anhídrido acético arrojó un rendimiento cuantitativo de 133. El éter cíclico de enol 134 se formó mediante la división oxidativa que promovió la adición intramolecular seguida de una desprotección básica y deshidratación. Se descubrió entonces que la bromación seguida de la deshidratación en el metanol daba una mezcla epimérica de insaturado 135. La hidrólisis, la reducción y la acetilación produjeron 136. La formación de un tiolactámico seguido de la condensación con bromoacetato de etilo dio 137. La desprotección selectiva del alcohol alílico seguida de la oxidación dio 138.
Una reacción de Wittig generó entonces un cloroalceno que, tras la eliminación del HCl promovida por la base, dio un alquitrán terminal, que posteriormente se protegió para formar 139. La función olefínica de 139 se redujo primero utilizando cianoborohidruro antes de seguir reduciendo 140 a una mezcla epimérica de alcoholes.
A continuación, se realizó una adición retro-Michael en condiciones básicas a baja temperatura, epimerizando con éxito este compuesto para obtener el epímero 141 deseado. Una reacción con trifenilfosfina generó entonces la sal de fosfonio 142, y se pudo realizar entonces una reacción Wittig para fijar la función cis-ene-yne protegida con sililo, que se desprotegió entonces para obtener el objetivo (±)-HTX 283A.

Mecanismo de acción de la histrionicotoxina
El HTX actúa como antagonista no competitivo de los receptores nicotínicos de acetilcolina, que están implicados en la señalización neuronal. Como antagonista no competitivo, el HTX se une a una subunidad del receptor nicotínico de acetilcolina, lo que en realidad aumenta la afinidad por la acetilcolina agonista y estabiliza el receptor desensibilizado, lo que bloquea los potenciales de acción y ralentiza la función neural.
Se ha demostrado que la histrionicotoxina se une competitivamente con muchos anestésicos locales, como la tetracaína, así como con otras aminas aromáticas antagonistas no competitivos de los receptores, lo que indica que los compuestos probablemente compartan un sitio de unión; este sitio de interacción se encuentra fuera del dominio transmembrana del receptor nicotínico de la acetilcolina, aunque la interacción exacta sigue sin estar caracterizada.
Si bien la histrionicotoxina comparte un sitio de unión con otros antagonistas no competitivos del receptor nicotínico de la acetilcolina, se ha demostrado que tiene una afinidad relativamente mayor con los receptores desensibilizados que la fenciclidina, lo que indica una mayor sutileza aún no caracterizada en la naturaleza de su unión.
Además, los estudios de los efectos de la histrionicotoxina sobre el potencial de la placa final han demostrado que el compuesto obstaculiza la propagación del potencial de la membrana, pero tiene características emergentes con las hiperpolarizaciones de la membrana. La unión de la histrionicotoxina es rápidamente reversible, por lo que se puede eliminar fácilmente de las regiones afectadas con lavados repetidos, o, in vivo, con difusión corporal natural. Se ha demostrado que las altas concentraciones de HTX tienen efectos antagónicos sobre la batrachotoxina.
La histrionicotoxina no es relativamente tan tóxica como otros alcaloides de las ranas venenosas. Las pruebas preliminares mostraron que los ratones podían sobrevivir a una dosis de 5 mg/kg de histrionicotoxina 283a y recuperarse en 3 horas sin efectos duraderos.
Para más información Histrionicotoxin | C19H25NO – PubChem
Como citar este artículo:
APA: (2021-08-03). Histrionicotoxina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/histrionicotoxina/
ACS: . Histrionicotoxina. https://quimicafacil.net/compuesto-de-la-semana/histrionicotoxina/. Fecha de consulta 2024-07-27.
IEEE: , "Histrionicotoxina," https://quimicafacil.net/compuesto-de-la-semana/histrionicotoxina/, fecha de consulta 2024-07-27.
Vancouver: . Histrionicotoxina. [Internet]. 2021-08-03 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/histrionicotoxina/.
MLA: . "Histrionicotoxina." https://quimicafacil.net/compuesto-de-la-semana/histrionicotoxina/. 2021-08-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net