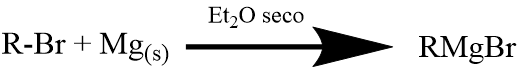Tiempo de lectura estimado: 8 minutos
Los reactivos de Grignard se preparan a partir de haluros de alquilo por tratamiento con magnesio metálico en forma de virutas en presencia de éter seco. La reacción se lleva a cabo satisfactoriamente sólo si el reactivo y el aparato están escrupulosamente secos.
El haluro de alquilmagnesio es soluble en la solución de éter y se utiliza en este medio. La solubilidad resulta de la solvatación del compuesto organometálico por el éter. Los disolventes de hidrocarburos no son útiles en la preparación de los agentes de Grignard porque no pueden disolver el producto.
Si el disolvente esta «húmedo» (es decir, contiene trazas de agua), el reactivo de Grignard se destruye tan rápido como se forma.
Además de reaccionar con H2O, los reactivos de Grignard también reaccionan con (y son descompuestos por) ácidos carboxílicos, alcoholes, aminas, sales de amonio y otros compuestos que son ligeramente ácidos. Los reactivos de Grignard también reaccionan con O2 y CO2 y si se desea un rendimiento muy alto del producto es preferible llevar a cabo la reacción en una atmósfera de nitrógeno.
En el presente experimento, la atmósfera libre de oxígeno se obtiene manteniendo la solución de éter caliente durante la preparación del reactivo. El éter es lo suficientemente volátil como para que un manto de vapor de éter sobre la solución mantenga el reactivo razonablemente bien aislado del contacto con el aire. Los órganometálicos, como los reactivos de Grignard y los organolitios, son reactivos muy utilizados en la síntesis orgánica. Este experimento ilustra el método utilizado para preparar un reactivo de Grignard, así como su reacción con dióxido de carbono para formar un ácido carboxílico.
Preparación de ácido benzoico
En este experimento se ilustrará la reacción de Grignard mediante la preparación del ácido benzoico formado en la reacción del bromuro de fenil magnesio con el dióxido de carbono (ecuación 2). Se proporcionará dióxido de carbono, en forma de CO2 sólido, pero el bromuro de fenilmagnesio se preparará a partir de bromobenceno según la ecuación 1, (R = C6H5), y luego se apagará con CO2 y se aislará el ácido benzoico de la mezcla de reacción acidificada (como se muestra en las ecuaciones (2) y (3)).
Materiales
- 1 matraz o balón de fondo plano de 100 mL
- 1 condensador recto
- 1 tubo de secado
- 1 barra de agitación magnética
- 1 pipeta volumétrica de 5 mL
- Propipeta o pipeteador
- Soporte universal
- Pinzas con nuez
- Varilla de vidrio
- Embudo de separación de 150 mL
- Baño de hielo
Reactivos
- Cloruro de calcio
- Magnesio
- Éter seco
- Éter para extracciones
- Bromobenceno
- Yodo
- Hielo seco (CO2)
- Ácido clorhídrico concentrado
- Hidróxido de sodio 1.0 M
- Papel rojo Congo
Procedimiento
PRECAUCIÓN: El éter es muy inflamable. NO utilice éter si hay una llama en el laboratorio.
Preparación del bromuro de fenilmagnesio
Monta un aparato de reflujo utilizando un matraz de 100 mL y un condensador provisto de un tubo de secado de cloruro de calcio. Asegúrate de que el matraz y el condensador estén SECOS antes de montar el aparato. Añade una barra de agitación magnética de 1″ y luego 0,25 g de Mg en el matraz, y vuelve a montar el aparato.
Sin agua de enfriamiento en el condensador, calienta el matraz en una manta calefactora o plancha de calentamiento haciéndolo girar suavemente. Cuando el matraz se enfríe, se aspirará aire seco en el aparato a través del tubo de secado, mientras que el calentamiento debería haber eliminado cualquier película de humedad en la superficie del magnesio o del matraz. Antes de continuar con el siguiente paso, conecta el condensador al agua de refrigeración.
Nota: asegúrese de que la entrada de agua fría a su condensador sea estanca y que no entren gotas de agua en la junta del matraz de fondo redondo. Evite que el caudal de agua sea demasiado alto.
Preparar un baño de hielo en caso de que alguna de las reacciones a realizar sea demasiado vigorosa. Retira el matraz del condensador, añade 5 mL de éter seco absoluto al matraz (hay dos tipos de éter disponibles, uno es un éter seco o «absoluto» especialmente preparado, el otro es éter ordinario que se utiliza para la extracción), y 1,35 mL (2,0 g) de bromobenceno, agitar el matraz para mezclar el éter y el bromobenceno y vuelve a montar el aparato y a poner en funcionamiento el agitador magnético.
Si se han seguido las instrucciones cuidadosamente (es decir, todo estaba limpio y seco) la reacción debería comenzar inmediatamente o después de un ligero calentamiento con las manos colocadas contra el fondo del matraz (la acción de agitación del agitador magnético también ayuda). Reconocerás que la reacción ha comenzado por la aparición de una turbidez en el éter y la eventual ebullición del mismo.
Si la reacción no se inicia, hay que llevar a cabo los siguientes pasos:
1. Con una varilla de agitación seca, aplasta un trozo de magnesio contra el fondo del matraz (¡cuidado con no romper el matraz!). La reacción debería comenzar, si no es así, prueba con la 2.
2. Calienta el matraz suavemente sobre un manto calefactor, dando vueltas. Retira el calor y comprueba si la ebullición continúa. Si no es así, prueba de nuevo con el punto 1. Si sigue sin haber reacción, pasa al punto 3.
3. Añadir un pequeño cristal de yodo. Si sigue sin haber reacción, calentar suavemente o añadir un par de gotas de 1,2-dibromoetano. Si sigue sin haber reacción, pasa al punto 4.
4. Suerte: inténtalo de nuevo pero esta vez sécalo todo. [Si utilizas una secuencia de agua y acetona para secar el matraz, asegúrate de hacer un enjuague final con 5 – 10 mL de éter para eliminar los últimos restos de acetona. La acetona sufre una reducción del pinacol con el Mg y esto parece inactivar la superficie del Mg para la formación de organometales].
En cuanto estés seguro de que la reacción se desarrolla satisfactoriamente, añade otros 6 mL de éter absoluto por la parte superior del condensador. La mezcla de reacción debe seguir hirviendo, pero si se vuelve lenta, aplique un calor suave con un manto calefactor hasta que todos los copos del magnesio, excepto los más pequeños, hayan desaparecido (detenga periódicamente el agitador para comprobar la cantidad de Mg que queda; esto puede llevar hasta 30 minutos).
Si en algún momento del proceso parece que se está perdiendo éter de la mezcla de reacción, añade unos cuantos mL más de éter a través de la parte superior del condensador mediante una pipeta cuentagotas, para mantener el volumen en unos 10-12 mL. Ahora has preparado una solución de bromuro de fenilmagnesio en éter y debe utilizarse inmediatamente en el siguiente paso.
Reacción del bromuro de fenilo y magnesio («fenil Grignard») con dióxido de carbono
Justo antes de estar listo para usarlo, coloque dióxido de carbono sólido finamente dividido (triturado) (7 g) en un vaso de precipitados. Con una agitación vigorosa, añade lentamente la solución preparada del reactivo de Grignard. Remover hasta que la mezcla se vuelva espesa y pegajosa.
Cuando el dióxido de carbono sólido haya desaparecido por completo, añadir lentamente una mezcla de agua (15 mL), hielo (15 g) y ácido clorhídrico concentrado (2,0 mL). Mezcla bien. Añadir la mezcla a un embudo de separación. Extraer la fase acuosa con dos porciones de éter (15 mL cada una). Combinar las capas de éter y extraerlas con tres porciones (7-8 mL cada una) de NaOH 1,0 M o 5% (lo que esté disponible). Combinar los extractos de NaOH y acidificar con ácido clorhídrico concentrado hasta pH 2 (papel rojo Congo). Asegúrate de que la mezcla de reacción esté razonablemente fría, ya que el ácido benzoico tiene una solubilidad apreciable en agua caliente.
(Si no se forma ningún precipitado, es probable que haya algo de éter en la superficie de la solución de ácido benzoico. Sopla suavemente el éter sobre la solución acidificada hasta que aparezcan los cristales. Continúe enfriando en un baño de hielo hasta que se complete la precipitación).
Recoger el precipitado por filtración al vacío. Secar el producto lo mejor posible, pesarlo y recristalizarlo a partir de agua caliente. (La capa de éter contiene compuestos neutros no polares como el bromobenceno y el bifenilo que no han reaccionado. Debe desecharse en el frasco de RESIDUOS ORGÁNICOS). Calcula el rendimiento del ácido benzoico. Toma una muestra del material recristalizado y determina su punto de fusión. (Coloca el resto de tu ácido benzoico en el frasco proporcionado).
Nota: al final del día, deseche el CaCl2 de su tubo de secado en el «residuo sólido inorgánico». Si no lo haces, al cabo de unos días te quedarás con una masa de CaCl2.2H2O «parecida a un ladrillo» que es muy tediosa de eliminar.
Para más información The Grignard Reaction. Preparation of Benzoic Acid
Como citar este artículo:
APA: (2022-03-23). La reacción de Grignard – Preparación de ácido benzoico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-organica/la-reaccion-de-grignard-preparacion-de-acido-benzoico/
ACS: . La reacción de Grignard – Preparación de ácido benzoico. https://quimicafacil.net/manual-de-laboratorio/q-organica/la-reaccion-de-grignard-preparacion-de-acido-benzoico/. Fecha de consulta 2026-03-08.
IEEE: , "La reacción de Grignard – Preparación de ácido benzoico," https://quimicafacil.net/manual-de-laboratorio/q-organica/la-reaccion-de-grignard-preparacion-de-acido-benzoico/, fecha de consulta 2026-03-08.
Vancouver: . La reacción de Grignard – Preparación de ácido benzoico. [Internet]. 2022-03-23 [citado 2026-03-08]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-organica/la-reaccion-de-grignard-preparacion-de-acido-benzoico/.
MLA: . "La reacción de Grignard – Preparación de ácido benzoico." https://quimicafacil.net/manual-de-laboratorio/q-organica/la-reaccion-de-grignard-preparacion-de-acido-benzoico/. 2022-03-23. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net