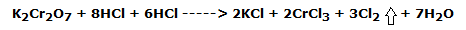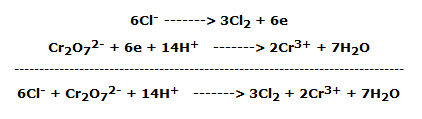Tiempo de lectura estimado: 5 minutos
El cloro es un elemento químico de símbolo Cl y número atómico 17. Es el segundo más ligero de los halógenos, aparece entre el flúor y el bromo en la tabla periódica y sus propiedades son mayoritariamente intermedias entre ambos. El cloro es un gas amarillo-verdoso a temperatura ambiente.
Es un elemento extremadamente reactivo y un fuerte agente oxidante: entre los elementos, tiene la mayor afinidad por los electrones y la tercera mayor electronegatividad en la escala de Pauling, sólo por detrás del oxígeno y el flúor.
El cloro desempeñó un papel importante en los experimentos realizados por los alquimistas medievales, que solían consistir en el calentamiento de sales de cloruro como el cloruro de amonio (sal amoniacal) y el cloruro de sodio (sal común), produciendo diversas sustancias químicas que contenían cloro, como el cloruro de hidrógeno, el cloruro de mercurio (II) (sublimado corrosivo) y el ácido clorhídrico (en forma de agua regia).
Sin embargo, la naturaleza del cloro gaseoso libre como sustancia independiente sólo fue reconocida hacia 1630 por Jan Baptist van Helmont. Carl Wilhelm Scheele escribió una descripción del cloro gaseoso en 1774, suponiendo que era un óxido de un nuevo elemento. En 1809, los químicos sugirieron que el gas podría ser un elemento puro, lo que fue confirmado por Sir Humphry Davy en 1810, quien le dio el nombre del griego antiguo: χλωρός, romanizado: khlôros, lit. ‘verde pálido’ por su color.
El cloro elemental se produce comercialmente a partir de la salmuera por electrólisis, principalmente en el proceso cloroalcalino. El alto potencial de oxidación del cloro elemental permitió desarrollar blanqueadores y desinfectantes comerciales, así como un reactivo para muchos procesos de la industria química. El cloro se utiliza en la fabricación de una amplia gama de productos de consumo, aproximadamente dos tercios de ellos productos químicos orgánicos como el cloruro de polivinilo (PVC), muchos productos intermedios para la producción de plásticos y otros productos finales que no contienen el elemento.
Como desinfectante habitual, el cloro elemental y los compuestos generadores de cloro se utilizan más directamente en las piscinas para mantenerlas higiénicas. El cloro elemental en altas concentraciones es extremadamente peligroso y venenoso para la mayoría de los organismos vivos.
Materiales
- 2 tubos de ensayo
- Espátula
- Pipeta graduada de 10 mL
- Propipeta o pipeteador
Reactivos
- Permanganato de potasio
- Dicromato de potasio
- Sol de ácido clorhídrico. 37 %
Procedimiento – Obtención de cloro
Se basa en dos reacciones de oxidación-reducción muy similares, en las que el ion Cl– es oxidado por dos agentes oxidantes fuertes como el permanganato de potasio y el dicromato de potasio en solución ácida.
Prepara dos tubos de ensayo con 5 ó 6 mL de agua destilada; en uno añade una punta de espátula de dicromato potásico; en el otro, la misma cantidad de permanganato potásico.
En el primer tubo de ensayo, con una pipeta, gotear unos 5 mL de sol de ácido clorhídrico. 37 %. Se observa el cambio del color anaranjado típico de las soluciones de Cr6+ al color amarillo-verde de las soluciones de Cr3+; al mismo tiempo se desarrolla el cloro, un gas de olor penetrante que, debido a su densidad unas 2,5 veces mayor que la del aire, no tiende a salir del tubo de ensayo.
La reacción redox que tiene lugar es la siguiente:
es decir, en forma iónica:
De la misma manera, deja caer unos 5 mL de sol de ácido clorhídrico. 37 % en el segundo tubo de ensayo; se observa el cambio del color violeta intenso, típico de las soluciones de ion Mn7+ al casi incoloro de las soluciones de Mn2+. Análogamente a la reacción anterior se produce el desarrollo del cloro, en la forma y con las características ya descritas.
La reacción es la siguiente:
en forma iónica:
Nota operativa: Para un buen resultado del experimento es necesario que las soluciones preparadas no estén demasiado concentradas. Basta, por tanto, con disolver muy poca sal en el agua.
El desarrollo del cloro no es, por regla general, masivo.
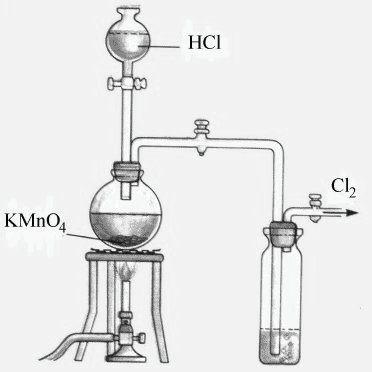
La siguiente figura muestra un sistema completo para el desarrollo y recolección de cloro, utilizando la segunda reacción:
Después del laboratorio.
Con base a las dos reacciones trabajadas en el laboratorio, determinar la cantidad necesaria de sales para producir 1 litro de gas cloro a condiciones normales asumiendo un exceso de ácido.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información How is chlorine prepared in the laboratory?
Como citar este artículo:
APA: (2021-09-29). Obtención de cloro. Recuperado de https://quimicafacil.net/manual-de-laboratorio/obtencion-de-cloro/
ACS: . Obtención de cloro. https://quimicafacil.net/manual-de-laboratorio/obtencion-de-cloro/. Fecha de consulta 2026-03-04.
IEEE: , "Obtención de cloro," https://quimicafacil.net/manual-de-laboratorio/obtencion-de-cloro/, fecha de consulta 2026-03-04.
Vancouver: . Obtención de cloro. [Internet]. 2021-09-29 [citado 2026-03-04]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/obtencion-de-cloro/.
MLA: . "Obtención de cloro." https://quimicafacil.net/manual-de-laboratorio/obtencion-de-cloro/. 2021-09-29. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net