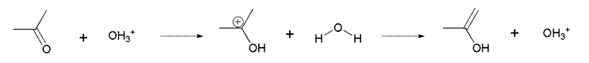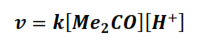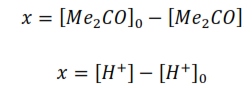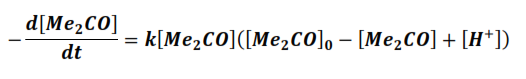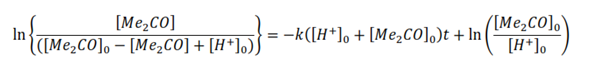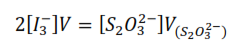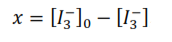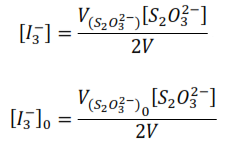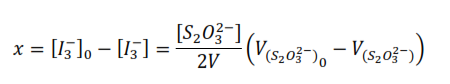Tiempo de lectura estimado: 9 minutos
Se dice que una reacción química es autocatalítica si uno de los productos de la reacción es también un catalizador de esta o de una reacción acoplada.
Se puede decir que un conjunto de reacciones químicas es «colectivamente autocatalítico» si varias de esas reacciones producen, como productos de reacción, catalizadores para un número suficiente de las otras reacciones, de manera que todo el conjunto de reacciones químicas es autosuficiente dado un aporte de energía y de moléculas alimenticias.
Estudio cinético de una reacción autocatalítica de segundo orden
Un ejemplo de reacción autocatalítica es la yodación de la acetona con catálisis ácida. La reacción global es:
Esta reacción es un ejemplo de autocatálisis, pues el producto H+ es catalizador de la reacción. Así, durante el transcurso de la reacción ocurren cambios en la concentración del catalizador.
Para esta reacción se ha propuesto un mecanismo constitutivo de 2 pasos:
1er paso: Enolización de la acetona: (paso lento)
2do paso: Interacción del yodo con la forma enólica:
De acuerdo con este mecanismo la expresión de la velocidad de la reacción es:
Donde:
v es la velocidad de la reacción.
k es la constante de velocidad específica de la reacción.
[Me2CO] es la concentración de la acetona.
[H+] es la concentración hidrogeniónica.
Debido a que la ecuación de velocidad presenta más de un término de concentración, para hallar su solución integral es necesario relacionar los términos de concentración de las especies. Según la ecuación global de la reacción en estudio, el balance material de las especies y considerando que la relación estequiométrica entre los reaccionantes y productos (1:1) se mantiene durante todo el proceso se tiene que:
De ahí que:
Entonces la expresión de la velocidad puede escribirse según:
De esta manera la expresión de la velocidad queda en función de una sola variable. Si la velocidad de la reacción se expresa como la variación de la concentración de la acetona con respeto al tiempo, entonces:
La solución de esta ecuación diferencial, empleando el método de las fracciones simples es:
Ordenando
Usando el balance de masa de la reacción
Empleando la última ecuación o alguna de las anteriores es posible calcular la constante de velocidad de reacción
Determinación experimental de X
- Extraer alícuotas de la mezcla reaccionante.
- Detener la reacción en la alícuota tomada por neutralización con una disolución de NaHCO3.
- Tomar el valor del tiempo en el momento que se detiene la reacción en la alícuota tomada.
- Proceder a su valoración con la disolución de tiosulfato de sodio en presencia de almidón.
- Anotar el valor del volumen consumido del agente valorante, cuando desaparece totalmente la coloración azul de la mezcla reaccionante, previamente neutralizada.
En este caso, la reacción que se verifica es una reacción redox, cuya ecuación iónica es:
Por lo tanto
Donde:
[I3–] es la concentración del ión triyoduro presente a tiempo.
V es el volumen de la alícuota de la mezcla reaccionante.
[S2O32-] es la concentración de la disolución de tiosulfato.
V[S2O32-] es el volumen consumido de la disolución de tiosulfato en la valoración.
Si se observa la ecuación química global, se tiene que la concentración del ión triyoduro que ha reaccionado al tiempo, es igual a la concentración de la acetona que ha reaccionado a ese tiempo, por lo tanto:
Así, si se valora la mezcla reaccionante al inicio:
Donde V[S2O32-] es el volumen consumido de la disolución de tiosulfato en la valoración.
Despejando [I3–]0 y [I3–]
Sustituyendo
La ecuación anterior se utiliza para calcular la concentración de la acetona que ha reaccionado al tiempo, que es igual a la concentración del ión triyoduro que ha reaccionado en ese tiempo.
Materiales
- 5 vasos de precipitados de 50 mL
- 3 espátulas.
- 3 agitadores de vidrio.
- 1 probeta de 50 mL
- 2 balones volumétricos de 500 mL
- vaso de precipitado de 1000 mL
- vaso de precipitado de 250 mL
- cápsula de porcelana
- 2 balones volumétricos de 1000 mL
- 4 pipetas de 25 mL
- Propipeta o pipeteador
- Balón volumétrico de 250 mL
- Pesafiltros o pesa sustancias
- bureta de 100 mL
- embudo de vidrio
- 6 Erlenmeyer
- Baño de María
- Cronometro
- Balanza analítica
- Termómetro ambiental
Reactivos
- Acido clorhídrico
- Yodo*
- Yoduro de potasio*
- Bicarbonato de sodio (carbonato acido de sodio)
- Tiosulfato de sodio
- Solución de almidón 1%
- Acetona
* Puede utilizarse solución de yodo – yoduro (Lugol)
Procedimiento – Estudio cinético de una reacción autocatalítica
Preparar las siguientes soluciones: acido clorhídrico 1M, solución de yoduro-yodo o Lugol, carbonato acido de sodio 0.1 M.
Tomar 25 mL de la disolución 0.1 M de I2, 25 mL de la disolución 1 M de HCl y colocarlos en un balón volumétrico de 250 mL. Añadir agua destilada en una cantidad que no llegue hasta el enrase, aproximadamente dejar vacío un volumen de 10 mL.
Adicionar 25 mL de la disolución 0.1 M de NaHCO3, a cada uno de los Erlenmeyer.
Pesar alrededor de 1.5 g de acetona en un pesafiltro con la tapa cerrada.
Añadir la acetona a la disolución preparada en el balón volumétrico de 250 mL, enrasar rápidamente con agua destilada y agitar enérgicamente para homogenizar la mezcla reaccionante.
En este momento poner en marcha el cronómetro. Tomar inmediatamente con la pipeta de 25 mL, una alícuota de la mezcla reaccionante (V).
Descargar la alícuota de la mezcla reaccionante a uno de los Erlenmeyer que contiene 25 mL de la disolución 0.1 M de NaHCO3 (tomar el tiempo en cuanto homogenice), añadir 2 o 3 gotas de la disolución de almidón, homogenizar y valorar con la disolución de Na2S2O3 0.01 M hasta que desaparezca totalmente la coloración azul.
Anotar el volumen consumido de la disolución de Na2S2O3.
Tomar alícuotas de 25 mL cada 20-25 minutos y repetir los dos pasos anteriores (de 5 a 6 veces), anotando cada vez el volumen consumido de la disolución de Na2S2O3 gastada y el tiempo cuando la alícuota de la mezcla reaccionante se descarga en el Erlenmeyer que contiene la disolución de NaHCO3, es decir cuando se detiene la reacción en esa alícuota.
Completar la siguiente tabla
Después del laboratorio
Calcular los valores de x y de la constante de velocidad de reacción y su valor medio, empleando la mayor cantidad de cifras significativas posibles.
Determinar K gráficamente
Para más información Autocatalysis: Kinetics, Mechanisms and Design
Como citar este artículo:
APA: (2022-06-08). Estudio cinético de una reacción autocatalítica. Recuperado de https://quimicafacil.net/manual-de-laboratorio/estudio-cinetico-de-una-reaccion-autocatalitica/
ACS: . Estudio cinético de una reacción autocatalítica. https://quimicafacil.net/manual-de-laboratorio/estudio-cinetico-de-una-reaccion-autocatalitica/. Fecha de consulta 2026-02-27.
IEEE: , "Estudio cinético de una reacción autocatalítica," https://quimicafacil.net/manual-de-laboratorio/estudio-cinetico-de-una-reaccion-autocatalitica/, fecha de consulta 2026-02-27.
Vancouver: . Estudio cinético de una reacción autocatalítica. [Internet]. 2022-06-08 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/estudio-cinetico-de-una-reaccion-autocatalitica/.
MLA: . "Estudio cinético de una reacción autocatalítica." https://quimicafacil.net/manual-de-laboratorio/estudio-cinetico-de-una-reaccion-autocatalitica/. 2022-06-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net