Tiempo de lectura estimado: 9 minutos
Los carbohidratos son compuestos orgánicos con la formula general Cm(H2O)n, su nombre se debe a la idea inicial que eran formas hidratadas del carbón. Constituyen la base de todas las sustancias orgánicas en el planeta y sus compuestos tienen papeles fundamentales en los seres vivientes.
El análisis de carbohidratos permite identificar sus características y propiedades tanto físicas como químicas, así como elucidar sus estructuras y átomos constituyentes. Es posible emplear una serie de reacciones para la identificación específica de estas biomoléculas, iniciando con una reacción general típica que los identifica, para luego discriminar y determinar si son poli, di o monosacáridos y diferenciar a su vez si son aldosas o cetosas y dentro de ellas si son pentosas o hexosas.
Clasificación de los carbohidratos
Los carbohidratos pueden dividirse de manera general en 4 grandes grupos; monosacáridos, disacáridos, oligosacáridos y polisacáridos. Los polisacáridos son moléculas que sirven para el almacenamiento de energía en los seres vivos, como por ejemplo el almidón. Por su parte, los oligosacáridos son polímeros de entre 3 a 10 unidades de monosacáridos y son responsables de muchas funciones biológicas de reconocimiento e interacción.
Los disacáridos son formados por dos unidades de monosacárido unidos por un enlace glicosídico, al igual que los monosacáridos son altamente solubles en agua. Los principales disacáridos son sucrosa, lactosa y maltosa. La unidad fundamental de todos los carbohidratos son los monosacáridos, que son la forma mas simple de un azúcar, siendo los principales monosacáridos la glucosa, fructosa, y galactosa.
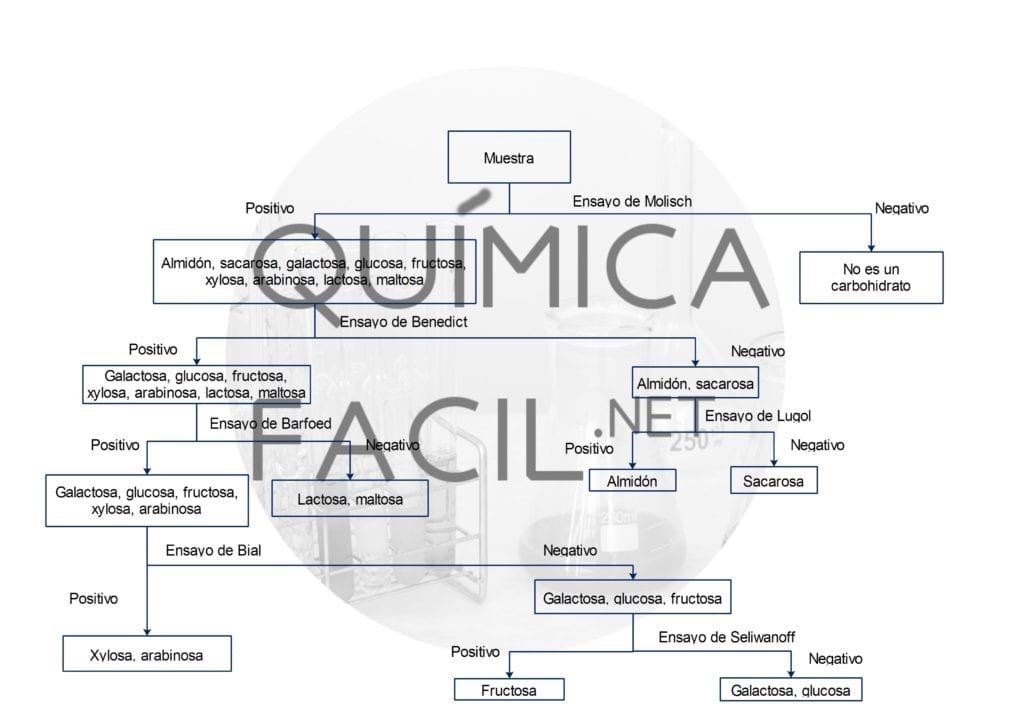
La marcha analítica para análisis de carbohidratos y su clasificación se inicia con la reacción de Molisch, llamada así en honor al botánico austriaco Hans Molisch, que permite la identificación si es un carbohidrato o no. Se basa en la deshidratación del carbohidrato por la acción de ácido sulfúrico concentrado, generándose un aldehído que se condensa con dos moléculas de un fenol generando un compuesto de color rojo o purpura.
El ensayo de Benedict identifica la presencia de grupos aldehído libres en la estructura del carbohidrato, es decir, la presencia de azucares reductores. El reactivo de Benedict es el mismo empleado en la identificación de aldehídos y cetonas y sigue su mismo fundamento.
El ensayo del lugol o del yoduro sirve para identificar si se esta manejando un polisacárido, un disacárido o un monosacárido. En la presencia de un polisacárido como el almidón, el ion triyoduro reacciona para generar un complejo con la estructura del almidón, que se visualiza con una coloración azul oscuro. Si es un monosacárido o disacárido no es posible la formación del complejo azul, así que no se observa el color. Un caso especial sucede en el análisis de eritrodextrinas, que en este ensayo genera un color rojo. También la presencia de nitrógeno en la molécula generara un color rojo en este ensayo.
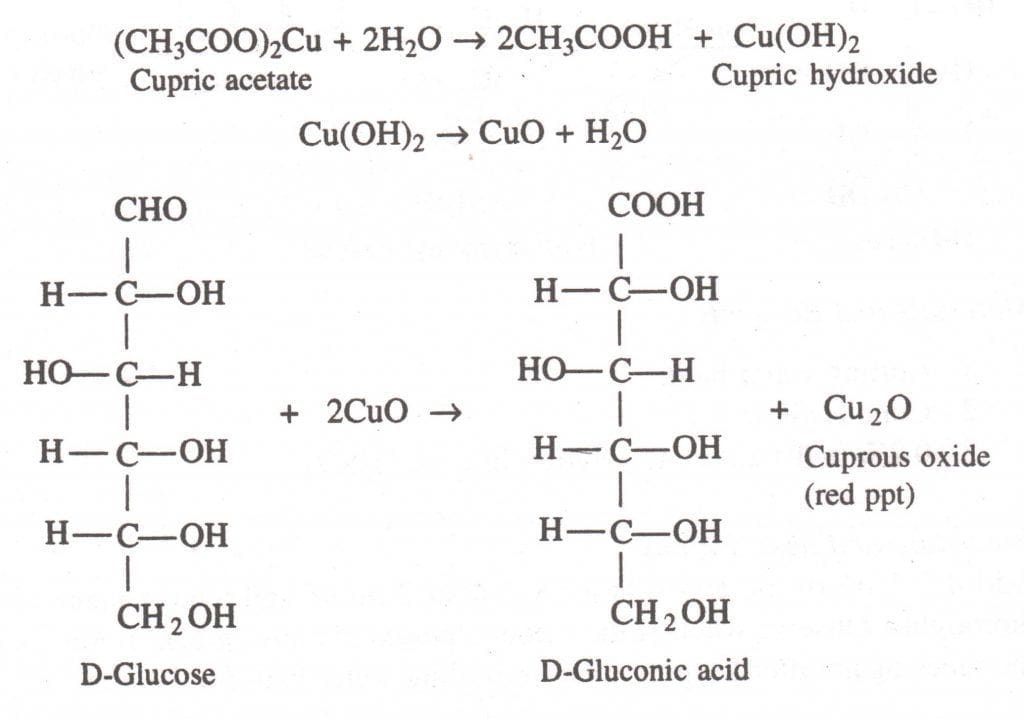
Si se identifica que es un mono o disacárido es de especial interés saber si es un azúcar reductor o no, para ello se emplea el ensayo de Barfoed. Este ensayo se basa en la capacidad de reducción del ion cobre que se precipita en forma de oxido de cobre (I) de color rojo ladrillo en la presencia de azucares reductores. Midiendo el tiempo de precipitación se puede tener indicios si es un monosacárido o un disacárido.
El reactivo de Barfoed consiste en una solución 0.33 M de acetato de cobre (II) en una solución de acido acético al 1% preparado en fresco. El acetato de cobre se hidroliza dando hidróxido de cobre (II) que se deshidrata a oxido de cobre (II). El óxido cúprico reacciona con el azúcar generando el ácido orgánico correspondiente y un precipitado de óxido de cobre (I).
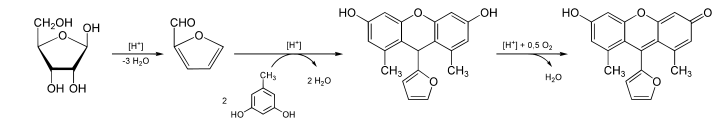
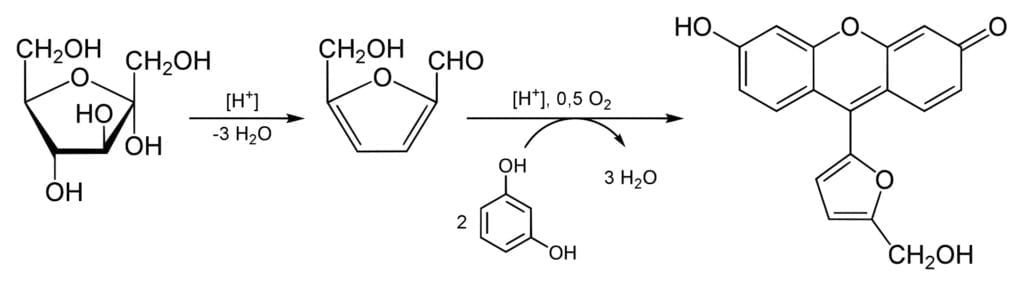
Cuando se identifica que es un monosacárido reductor se pueden aplicar dos pruebas para saber si se trata de una hexosa o pentosa, y si es una aldosa o cetosa. El ensayo de Bial se usa para detectar la presencia de pentosas. El reactivo de Bial está compuesto por orcinol, acido clorhídrico y cloruro férrico.
Si una pentosa está presente, se deshidratará para formar furfural que reaccionará con el orcinol para general un compuesto coloreado. Si se desea una mayor precisión en el ensayo, se puede emplear espectroscopia para confirmar la identidad del compuesto formado.
Por ultimo se aplica el ensayo de Seliwanof, que se emplea para diferenciar entre aldosas y cetosas. El fundamento químico del ensayo es que las cetosas al ser calentadas en un medio acido, se deshidratan más rápido que las aldosas, y reaccionan con dos equivalentes de resorcinol para producir una molécula de color rojo cereza, indicativo de reacción positiva
Las aldosas también reaccionaran, pero más lentamente, dando un ligero tono rosado fácilmente diferenciable del resultado positivo.
A continuación, se muestra el resumen general de la marcha para análisis de carbohidratos
Materiales
- 20 tubos de Ensayo
- Gradilla
- Beaker de 250 mL
- Pipeta de 10 mL
- Pinzas para tubo de ensayo
- Agitador de vidrio
- Vidrio de reloj
- Plancha de calentamiento
Reactivos
- Agua Destilada
- Acido sulfúrico concentrado
- Reactivos:
- lugol
- Molisch
- Benedict
- Barfoed
- Bial
- Seliwanoff
- Muestras de 3 a 6 carbohidratos disponibles según criterio del tutor.
Ensayos para análisis de carbohidratos
Ensayo de Molisch
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver) y agregar cuatro gotas de reactivo de Molisch.
En otro tubo, colocar 0,5 mL de ácido sulfúrico concentrado. inclinar un poco el tubo de ensayo, adicionando cuidadosamente la solución del carbohidrato preparada con anterioridad, buscando que quede encima del ácido sulfúrico.
El desarrollo de un color púrpura – violeta en la interfase de las dos soluciones se considera como positivo.
Ensayo de Benedict
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Agregue 0,5 mL de reactivo de Benedict.
Colocar los tubos en un baño de agua hirviendo durante tres minutos. La aparición de un precipitado oscuro es resultado positivo para carbohidratos reductores. Registrar las observaciones.
Ensayo del Lugol
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Adicionar cinco gotas de la solución de Lugol a cada tubo de ensayo, observar los cambios que se presentan y anotar las observaciones.
Ensayo de Barfoed
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Agregar 0,5 mL de reactivo de Barfoed
Calentar los tubos a baño de María. Si se forma precipitado en dos a siete minutos, la sustancia es un monosacárido. Después de siete minutos, el ensayo es positivo para los disacáridos. Observar los cambios que se presentan y anotar las observaciones.
Ensayo de Bial
Para hacer el ensayo o la prueba de Bial para carbohidratos el procedimiento es el siguiente.
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Agregar 0,5 mL de reactivo de Bial.
Calentar los tubos de ensayo a baño de María. La aparición de un color o un precipitado verde es ensayo positivo. Observar los cambios que se presentan y anotar las observaciones.
Ensayo de Seliwanoff
Tomar un tubo de ensayo limpio y seco por cada sustancia a analizar y marcar con el nombre de esta. Adicionar 0,5 mL o 0,25 g de la sustancia a analizar (en caso de ser solida añadir 1 mL de etanol purificado y agitar hasta disolver). Agregar 0,5 mL de reactivo de Seliwanoff.
Calentar los tubos de ensayo a baño de María. El desarrollo de un color rojo en dos minutos es prueba positiva para cetosas. Observar los cambios que se presentan y anotar las observaciones.
Después del experimento
Para cada una de las sustancias sometidas a la marcha analítica para análisis de carbohidratos, escribir la reacción correspondiente en cada ensayo en caso de obtener un resultado positivo. En el caso de resultado negativo, explicar el porque no se da la reacción.
Recomendaciones de seguridad
Manejar con precaución los tubos de ensayo calentados al baño de maría con la ayuda de pinzas.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Experiment 1- qualitative analysis of carbohydrates
Como citar este artículo:
APA: (2019-02-20). Análisis de carbohidratos. Recuperado de https://quimicafacil.net/manual-de-laboratorio/analisis-de-carbohidratos/
ACS: . Análisis de carbohidratos. https://quimicafacil.net/manual-de-laboratorio/analisis-de-carbohidratos/. Fecha de consulta 2026-02-17.
IEEE: , "Análisis de carbohidratos," https://quimicafacil.net/manual-de-laboratorio/analisis-de-carbohidratos/, fecha de consulta 2026-02-17.
Vancouver: . Análisis de carbohidratos. [Internet]. 2019-02-20 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/analisis-de-carbohidratos/.
MLA: . "Análisis de carbohidratos." https://quimicafacil.net/manual-de-laboratorio/analisis-de-carbohidratos/. 2019-02-20. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net