Tiempo de lectura estimado: 7 minutos
La oxitocina (Oxt o OT) es una hormona peptídica y un neuropéptido que normalmente se produce en el hipotálamo y es liberada por la hipófisis posterior. Desempeña un papel en la creación de vínculos sociales, la reproducción, el parto y el periodo posterior al parto.
La oxitocina se libera en el torrente sanguíneo como hormona en respuesta a la actividad sexual y durante el parto. También está disponible en forma farmacéutica. En ambas formas, esta hormona estimula las contracciones uterinas para acelerar el proceso de parto. En su forma natural, también desempeña un papel en la creación de vínculos afectivos con el bebé y en la producción de leche.
La producción y secreción de oxitocina se controla mediante un mecanismo de retroalimentación positiva, en el que su liberación inicial estimula la producción y liberación de más oxitocina. Por ejemplo, cuando se libera esta hormona durante una contracción del útero al comienzo del parto, esto estimula la producción y liberación de más oxitocina y un aumento de la intensidad y frecuencia de las contracciones. Este proceso se agrava en intensidad y frecuencia y continúa hasta que cesa la actividad desencadenante. Un proceso similar tiene lugar durante la lactancia y durante la actividad sexual.
Historia de la oxitocina
La oxitocina se descubrió en 1909, cuando Sir Henry H. Dale comprobó que un extracto de la hipófisis posterior humana contraía el útero de una gata embarazada (la hormona se encuentra sin cambios en todas las especies de mamíferos). Dale bautizó la sustancia desconocida como oxitocina, utilizando las palabras griegas para «rápido» y «nacimiento».
Ya en 1911, los médicos comenzaron a utilizar el extracto de hipófisis para estimular las contracciones del parto. Posteriormente, Dale descubrió que el mismo extracto facilita la liberación de la leche materna. La oxitocina contrae las células del músculo liso que rodean las glándulas mamarias para mover la leche hacia el pezón, lo que se denomina «bajada de leche».
Unos 50 años después, el bioquímico Vincent du Vigneaud se ocupó de la potente sustancia hipofisaria. A lo largo de su carrera, du Vigneaud estudió la relación entre la estructura y la función de los compuestos de importancia biológica, y se propuso definir la estructura de la oxitocina. En 1953, ya había identificado los nueve aminoácidos, los había colocado en el orden y la distribución correctos, y había descubierto el enlace disulfuro biológicamente importante entre dos cisteínas que crea un anillo en la hormona peptídica. Para asegurarse de que lo tenía claro, du Vigneaud sintetizó el compuesto, la primera síntesis de una hormona peptídica. Su trabajo le valió el Premio Nobel de Química en 1955.
En la década siguiente, Iphigenia Photaki siguió trabajando en diferentes vías de síntesis, así como en la preparación de análogos de la hormona (por ejemplo, la 4-deamido-oxitocina).
Estructura química
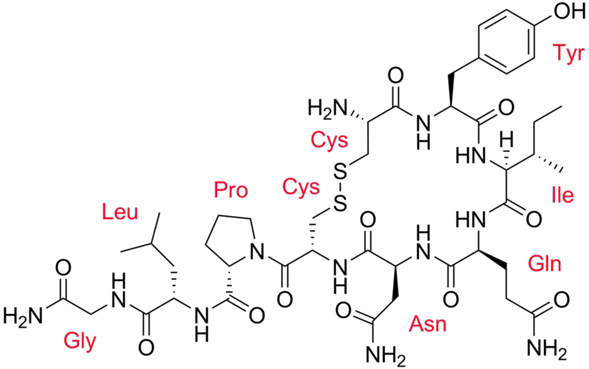
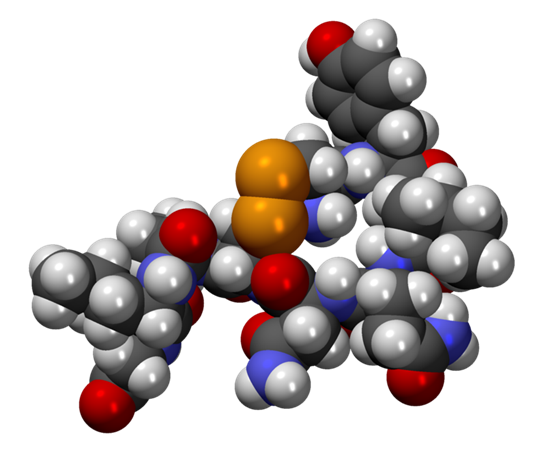
La oxitocina es un péptido de nueve aminoácidos (un nonapéptido) en la secuencia cisteína-tirosina-isoleucina-glutamina-asparagina-cisteína-prolina-leucina-glicina-amida (Cys – Tyr – Ile – Gln – Asn – Cys – Pro – Leu – Gly – NH2, o CYIQNCPLG-NH2); su extremo C se ha convertido en una amida primaria y un puente disulfuro une las partes de cisteína. La oxitocina tiene una masa molecular de 1007 Da, y una unidad internacional (UI) de oxitocina equivale a 1,68 μg de péptido puro.
Aunque la estructura de esta hormona está muy conservada en los mamíferos placentarios, en 2011 se informó de una nueva estructura de la esta hormona en titíes, tamarinos y otros primates del nuevo mundo. La secuenciación genómica del gen de la oxitocina reveló una única mutación dentro del marco (timina por citosina) que da lugar a una única sustitución de aminoácidos en la posición 8 (prolina por leucina)
Desde este artículo original de Lee et al., otros dos laboratorios han confirmado la Pro8-OT y han documentado variantes estructurales adicionales de la oxitocina en este taxón de primates. Vargas-Pinilla et al. secuenciaron las regiones de codificación del gen OXT en otros géneros de primates del nuevo mundo e identificaron las siguientes variantes además de Leu8- y Pro8-OT: Ala8-OT, Thr8-OT, y Val3/Pro8-OT. Ren et al. identificaron una variante más, Phe2-OT en monos aulladores.
La forma biológicamente activa de la oxitocina, comúnmente medida por técnicas RIA y/o HPLC, es el octapéptido oxidado disulfuro de oxitocina, pero también existe como un ditiol reducido de cadena recta (no cíclica) no-péptido llamado oxitocina. Se ha teorizado que la oxitocina puede actuar como un eliminador de radicales libres, ya que la donación de un electrón a un radical libre permite que la hormona se reoxide a oxitocina a través del par redox dehidroascorbato/ascorbato.
La estructura de la oxitocina es muy similar a la de la vasopresina. Ambas son nonapéptidos con un único puente disulfuro, y sólo se diferencian por dos sustituciones en la secuencia de aminoácidos : Cys – Tyr – Phe – Gln – Asn – Cys – Pro – Arg – Gly – NH2. Ambas moléculas se aislaron y su síntesis total se comunicó en 1954, trabajo por el que Vincent du Vigneaud fue galardonado con el Premio Nobel de Química de 1955 con la mención: «por sus trabajos sobre compuestos de azufre de importancia bioquímica, especialmente por la primera síntesis de una hormona polipeptídica».
La oxitocina y la vasopresina son las únicas hormonas conocidas liberadas por la hipófisis posterior humana que actúan a distancia. Sin embargo, las mismas neuronas que producen esta hormona también producen otros péptidos, como la hormona liberadora de corticotropina y la dinorfina, por ejemplo, que actúan a nivel local. Las células neurosecretoras magnocelulares que fabrican oxitocina son adyacentes a las células neurosecretoras magnocelulares que fabrican vasopresina. Se trata de grandes neuronas neuroendocrinas que son excitables y pueden generar potenciales de acción.
Bioquímica
Se ha comprobado que los estrógenos aumentan la secreción de esta hormona y la expresión de su receptor, el receptor de oxitocina, en el cerebro. En las mujeres, se ha comprobado que una sola dosis de estradiol es suficiente para aumentar las concentraciones de oxitocina circulante.
La oxitocina y la vasopresina son las únicas hormonas conocidas liberadas por la hipófisis posterior humana que actúan a distancia. Sin embargo, las neuronas de la oxitocina producen otros péptidos, como la hormona liberadora de corticotropina (CRH) y la dinorfina, por ejemplo, que actúan a nivel local. Las neuronas magnocelulares que producen esta hormona son adyacentes a las neuronas magnocelulares que producen vasopresina, y son similares en muchos aspectos.
El péptido de la oxitocina se sintetiza como una proteína precursora inactiva a partir del gen OXT. Esta proteína precursora también incluye la proteína transportadora de la oxitocina, la neurofisina I. La proteína precursora inactiva se hidroliza progresivamente en fragmentos más pequeños (uno de los cuales es la neurofisina I) mediante una serie de enzimas. La última hidrólisis que libera el nonapéptido activo de la oxitocina es catalizada por la peptidilglicina alfa-amidante monooxigenasa (PAM).
La actividad del sistema enzimático PAM depende de la vitamina C (ascorbato), que es un cofactor vitamínico necesario. Por casualidad, se descubrió que el ascorbato de sodio por sí mismo estimula la producción de oxitocina del tejido ovárico en un rango de concentraciones de manera dependiente de la dosis. Muchos de los mismos tejidos (por ejemplo, ovarios, testículos, ojos, suprarrenales, placenta, timo, páncreas) donde se encuentra la PAM (y la oxitocina por defecto) también se sabe que almacenan concentraciones más altas de vitamina C.
Se sabe que la oxitocina es metabolizada por la oxitocinasa, leucyl/cystinyl aminopeptidase. También se sabe que existen otras oxitocinasas. Se ha descubierto que la amastatina, la bestatina (ubenimex), la leupeptina y la puromicina inhiben la degradación enzimática de la oxitocina, aunque también inhiben la degradación de varios otros péptidos, como la vasopresina, la metenkefalina y la dinorfina A.
Para más información Oxytocin
Como citar este artículo:
APA: (2022-11-22). Oxitocina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/oxitocina/
ACS: . Oxitocina. https://quimicafacil.net/compuesto-de-la-semana/oxitocina/. Fecha de consulta 2025-07-05.
IEEE: , "Oxitocina," https://quimicafacil.net/compuesto-de-la-semana/oxitocina/, fecha de consulta 2025-07-05.
Vancouver: . Oxitocina. [Internet]. 2022-11-22 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/oxitocina/.
MLA: . "Oxitocina." https://quimicafacil.net/compuesto-de-la-semana/oxitocina/. 2022-11-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net