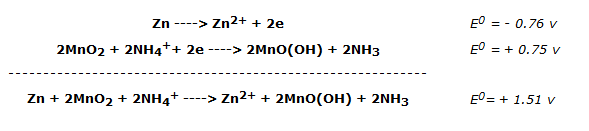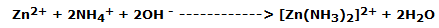Actualizado en enero 10, 2024
Tiempo de lectura estimado: 4 minutos
La pila de Leclanché es una batería inventada y patentada por el científico francés Georges Leclanché en 1866. La pila contenía una solución conductora (electrolito) de cloruro de amonio, un cátodo (terminal positivo) de carbono, un despolarizador de dióxido de manganeso (oxidante) y un ánodo (terminal negativo) de zinc (reductor). La química de esta pila se adaptó posteriormente con éxito para fabricar una pila seca.
Funcionamiento de la pila de pila de Leclanché
En la célula seca de Leclanché las soluciones en las que se sumergen los electrodos se sustituyen por polvos gelatinosos. El revestimiento externo es de zinc y actúa como ánodo ( – ). Una barra de grafito, sumergida en la papilla tiene la función exclusiva de conductor de la misma, compuesta por MnO2, NH4Cl, ZnCl2, negro de humo, almidón y H2O, que actúa como cátodo ( + ).
Durante el funcionamiento, el zinc se oxida y el dióxido de manganeso se reduce.
Las semirreacciones siguen siendo objeto de debate, aunque las más probables parecen ser las siguientes:
La f.e.m. expresada por la pila de Leclanché es, por tanto, de unos 1,5 voltios.
La pila de Leclanché se descarga cuando las reacciones alcanzan el equilibrio. Los iones Zn2+ producidos por la oxidación anódica reaccionan con los iones de la papilla con la reacción:
Esto mantiene la concentración de Zn2+ baja y, en consecuencia, la f.e.m. constante. En la pila que queda en reposo, la oxidación de este ion complejo genera un potencial más alto que el del zinc, por lo que la pila puede recuperar parte de su carga.
El amoníaco que se libera en el cátodo aísla la barra de grafito, interrumpiendo el flujo de electrones. El f.e.m. disminuye entonces progresivamente.
Materiales
- Pila de Leclanché (modelo didáctico)*
- Voltímetro
- Amperímetro
- Bombilla 1,5 V, 0,3 A
- Cables.
Reactivos
- Oxido de manganeso (IV) en polvo
- Polvo de grafito
- Barra de grafito
- Cloruro de amonio sol. 10 %
Procedimiento
Coloque el ánodo de zinc cilíndrico en el recipiente de plástico. En el interior del recipiente se coloca el complejo formado por el cilindro de grafito y el recipiente poroso lleno de óxido de manganeso (IV) y polvo de grafito. La solución de cloruro de amonio se vierte en el espacio restante hasta cubrir el conjunto. Este conjunto forma el cátodo.
Utilizando dos cables de distinto color, conecta el ánodo y el cátodo con un voltímetro, respetando la polaridad, y mide el f.e.m. Esto equivale a unos 1,5 voltios.
A continuación, se conecta la batería al amperímetro y a un elemento con el cual se pueda verificar la corriente, por ejemplo, una bombilla de 1,5 v y 0,3 A, formando un circuito eléctrico adecuado; así se determina la intensidad de la corriente producida. En el caso de la batería educativa, esta intensidad equivale a unos 0,5 A; por tanto, es capaz de encender la bombilla.
Al final del experimento, los elementos se lavan cuidadosamente con agua corriente y se secan al aire.
*Los modelos didácticos de la pila de Leclanché en ocasiones incluyen el conjunto formado por la barra de grafito, grafito en polvo y oxido de manganeso (IV), si no es el caso se puede rellenar con estos reactivos en relación estequiométrica según la reacción global.
En caso de no disponer de un modelo didáctico de la pila de Leclanché puede improvisarse uno con un recipiente plástico que contenga todo el conjunto y un recipiente poroso de cerámica o plástico para contener el cátodo.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Leclanche Cell Construction and Working Principle
Como citar este artículo:
APA: (2021-04-28). La pila de Leclanché. Recuperado de https://quimicafacil.net/manual-de-laboratorio/la-pila-de-leclanche/
ACS: . La pila de Leclanché. https://quimicafacil.net/manual-de-laboratorio/la-pila-de-leclanche/. Fecha de consulta 2024-07-27.
IEEE: , "La pila de Leclanché," https://quimicafacil.net/manual-de-laboratorio/la-pila-de-leclanche/, fecha de consulta 2024-07-27.
Vancouver: . La pila de Leclanché. [Internet]. 2021-04-28 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/la-pila-de-leclanche/.
MLA: . "La pila de Leclanché." https://quimicafacil.net/manual-de-laboratorio/la-pila-de-leclanche/. 2021-04-28. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net