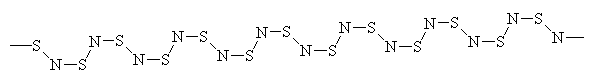Actualizado en febrero 15, 2022
Tiempo de lectura estimado: 10 minutos
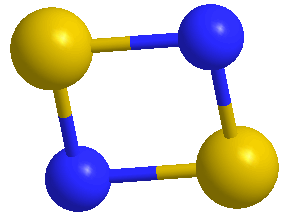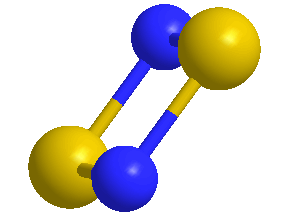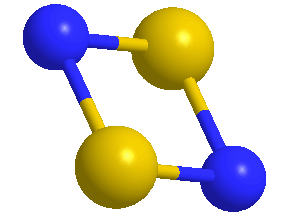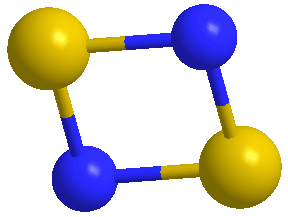
El dinitruro de azufre un compuesto químico S2N2 con una estructura cíclica plana cuadrada. Es un compuesto químico inorgánico de azufre del grupo de los nitruros covalentes. El compuesto pertenece al grupo de los compuestos de azufre-nitrógeno o nitruros de azufre, junto con el nitruro de hexano de pentasulfuro, el dióxido de tetrasulfuro, el tetranitrito de tetrasulfuro, el mononitrito de monosulfuro, el dióxido de oligosulfuro y el politiacilo polimérico (SN)x.
Características del dinitruro de azufre
La naturaleza del enlace en el S2N2 (y otros compuestos N-S) está lejos de ser obvia. Una de las preguntas favoritas de los exámenes universitarios de primer año es: «Se dice que el S2N2 es aromático». Discútelo». La respuesta es que la molécula es plana y posee seis electrones en orbitales de simetría p, lo que implica cierta similitud con la molécula de benceno. En realidad, nada más lejos de la realidad.

Entonces, ¿cuál es tipo de enlace correcto y la estructura del S2N2? Según Greenwood y Earnshaw , la geometría de la molécula de S2N2 es, de hecho, casi exactamente un cuadrado, a pesar de la disparidad en los tamaños de los átomos S y N: Las longitudes de enlace S-N, determinadas a partir de estudios de difracción de rayos X, son 165,1 y 165,7 pm, el ángulo de enlace S-N-S es de 90,4°, mientras que el ángulo N-S-N es de 89,9°.
A temperatura ambiente, el S2N2 se polimeriza fácilmente para formar (SN)x, que es metálico. A temperaturas muy bajas (0,33K), el polímero se convierte en superconductor. Por consiguiente, hay mucho sobre la estructura electrónica de este sistema que justifica un estudio detallado del monómero de S2N2 en sí mismo.
Podemos calcular la estructura de moléculas como el S2N2 usando el método de enlace de valencia acoplado por espín. La función de onda acoplada al espín incorpora mucha correlación de electrones químicamente significativa en una forma compacta y altamente visual. Este enfoque para la determinación de la estructura electrónica molecular se describe en detalle en varios lugares. Los seis orbitales p, cada uno de los cuales está ocupado individualmente, se muestran en la figura 1 a continuación.
Los contornos se trazan en un plano paralelo al de la molécula y 1 Bohr por encima de ella. A partir de esto, vemos inmediatamente que en cada uno de los dos átomos S sólo hay un único orbital p: orbitales f1 y f2 respectivamente. Se puede ver que están bien localizados. Cada átomo N también tiene un único orbital p muy localizado centrado en él (orbitales f4 y f5 respectivamente). Además, hay dos orbitales p tricentrales, simétricamente relacionados entre sí, centrados en cada átomo N y que se extienden sobre los dos subsistemas S-N-S (orbitales f3 y f6). Los átomos de azufre llevan una carga positiva importante, +0,52e en la base DZP, y los átomos de nitrógeno una carga negativa complementaria.
Una transposición de los orbitales f1 y f2, los orbitales p en los átomos S, equivale a una operación de simetría de la molécula: es decir, la transposición equivale a una reflexión en un plano perpendicular al de la molécula y que atraviesa ambos átomos N. Dado que la función de onda electrónica total para el estado basal, Y00, pertenece a la representación totalmente simétrica Ag de D2h, debe permanecer invariable bajo esta operación.
Por consiguiente, Y00 debe ser simétrico hacia el intercambio de las coordenadas espaciales de los dos electrones descritos por f1 y f2. Esto significa que en un estado de simetría Ag en D2h, los giros de los electrones en f1 y f2 deben acoplarse exactamente a un singlete. La función de espín «perfectamente apareado», según la cual los espines de los pares orbitales (f1, f2), (f3, f4) y (f5, f6), están a una excelente aproximación simplemente apareados en singletes, predomina fuertemente.
De un vistazo inicial a estos resultados, se podría concluir que existe un vínculo directo S-S p. Sin embargo, un examen más detallado de los orbitales f1 y f2, (es decir, en un plano perpendicular al plano molecular y que atraviesa ambos átomos S), muestra que no es así, como puede verse en la figura 2.
Los orbitales f1 y f2 poseen cada una una superficie nodal, aproximadamente a mitad de camino entre los dos átomos S, los lóbulos de f1 y f2 están doblados ligeramente lejos del otro átomo S compañero y la densidad total de electrones disminuye realmente dentro del anillo S2N2. Estas superficies nodales se originan en las superficies nodales radiales presentes en las órbitas 3p del azufre.
Normalmente, cuando dos orbitales de átomos diferentes se superponen y se emparejan los espines de los electrones que ocupan cada uno de ellos, consideramos que se trata de un único vínculo. De lo contrario, si los dos orbitales resultan ser ortogonales, ya sea exactamente por simetría, o efectivamente así debido a la distancia entre ellos, el estado más bajo se obtiene normalmente cuando los espines de los electrones se acoplan a un triplete. La molécula se denomina entonces un diradical. En el S2N2, surge una situación diferente: Las órbitas f1 y f2 se superponen y los espines correspondientes se acoplan a un singlete. Sin embargo, no se forma un verdadero vínculo. Por lo tanto, consideramos que S2N2 en su estado electrónico terrestre se describe mejor como un singlete diradical.
Un momento de reflexión nos convencerá de que este patrón de unión está de acuerdo con todas las valencias dentro de esta única «estructura de acoplamiento de espines», aunque de una manera muy inesperada: Los iones N tienen una valencia de dos y, por consiguiente, forman dos vínculos simples de simetría con un ángulo de unión entre ellos de 90°, uno con cada uno de los átomos S vecinos. Los iones S+ tienen una valencia de tres y, por consiguiente, cada uno de ellos forma dos enlaces de simetría con los iones N- adyacentes. Por lo tanto, tenemos un marco de enlace único de s para S2N2. Los dos electrones restantes ocupan cada uno una sola órbita p en cada átomo S y están unidos entre sí. Debido a que las órbitas involucradas son puramente de carácter p, la cuestión de los ángulos de enlace no se plantea. Por lo tanto, el S2N2 puede representarse razonablemente bien mediante el esquema de enlace que se muestra en la figura 3, en el que la línea punteada que une los dos átomos S indica el carácter singlete diradical del enlace.

(SN)x – un polímero conductor
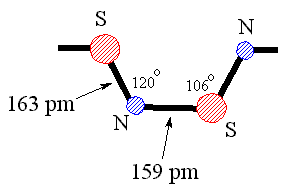
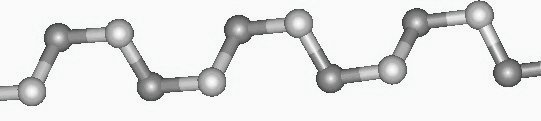
El dinitruro de azufre puede explotar, y también puede ser térmicamente polimerizado para dar el polímero (SN)x, que es conductor eléctrico. ¿Podemos explicar este comportamiento metálico en base a su unión? La estructura geométrica de la cadena (SN)x, que no es completamente plana, se muestra en la figura 4.
Vemos así que la cadena (SN)x parece consistir, además de los electrones que forman los enlaces s que la mantienen unida, en un orbital p ocupado individualmente en cada átomo S, intercalado con un par p solitario centrado alrededor de cada átomo N. Por lo tanto, el polímero puede considerarse, con una buena aproximación, como una cadena unidimensional de átomos S, con un solo electrón en cada sitio. Esto equivale a una banda medio llena y, por consiguiente, se podría predecir que el polímero es metálico, de acuerdo con la observación.
Preparación y reacciones
Al pasar el S4N4 gaseoso sobre la lana metálica de plata a 250-300 °C a baja presión (1mm Hg) se obtiene dinitruro de azufre cíclico. La plata reacciona con el azufre producido por la descomposición térmica del S4N4 para formar Ag2S, y el Ag2S resultante cataliza la conversión del S4N4 restante en el anillo de cuatro miembros S2N2
Una alternativa utiliza el menos explosivo S4N3Cl. El dinitruro de azufre se descompone explosivamente por encima de los 30°C, y es sensible a los choques. Se sublima fácilmente, y es soluble en el éter dietílico. Rastros de agua hacen que se polimerice en S4N4. En el estado sólido se polimeriza espontáneamente formando (SN)x. Forma aductos con ácidos de Lewis a través de un átomo de nitrógeno, por ejemplo, S2N2 – BCl3, S2N2 – 2AlCl3, S2N2 – SbCl5, S2N2 – 2SbCl5.
Para más información Disulfur dinitride | N2S2 – PubChem
Como citar este artículo:
APA: (2021-03-30). Dinitruro de azufre. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/dinitruro-de-azufre/
ACS: . Dinitruro de azufre. https://quimicafacil.net/compuesto-de-la-semana/dinitruro-de-azufre/. Fecha de consulta 2024-07-27.
IEEE: , "Dinitruro de azufre," https://quimicafacil.net/compuesto-de-la-semana/dinitruro-de-azufre/, fecha de consulta 2024-07-27.
Vancouver: . Dinitruro de azufre. [Internet]. 2021-03-30 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/dinitruro-de-azufre/.
MLA: . "Dinitruro de azufre." https://quimicafacil.net/compuesto-de-la-semana/dinitruro-de-azufre/. 2021-03-30. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net