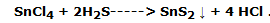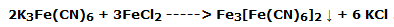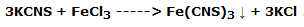Actualizado en enero 30, 2022
Tiempo de lectura estimado: 5 minutos
El equilibrio químico es un estado en el que la velocidad de la reacción hacia adelante es igual a la velocidad de la reacción hacia atrás. En otras palabras, no hay un cambio neto en las concentraciones de reactivos y productos. Este tipo de equilibrio también se denomina equilibrio dinámico.
El estado de equilibrio químico describe las concentraciones de reactivos y productos en una reacción que tiene lugar en un sistema cerrado, que ya no cambian con el tiempo. En otras palabras, la velocidad de la reacción directa es igual a la velocidad de la reacción inversa, de manera que las concentraciones de reactivos y productos permanecen bastante estables, en una reacción química. El equilibrio se indica en una ecuación química con el símbolo ⇌.
La constante de equilibrio, K, expresa la relación entre los productos y los reactivos de una reacción en equilibrio con respecto a una unidad específica.
Materiales
- 2 vasos de precipitados de 200 mL
- 1 probeta graduada de 100 mL
- 1 pipeta graduada de 10 mL
- 1 Erlenmeyer de 50 mL
- 4 tubos de ensayo
- Propipeta o pipeteador
- Goteros o pipetas Pasteur
Reactivos
- Cloruro de estaño II
- Cloruro de hierro III
- Ácido clorhídrico sol. 1:3 y sol. 37 %
- Hidróxido de sodio sol. 1 M
- Hidróxido de amonio sol. 25 %
- Tiocianato de potasio
- Ferricianuro de potasio
- Sulfuro de hierro
Procedimiento
El experimento debe verificar la presencia en una solución de todas las especies químicas que intervienen en la reacción de equilibrio:
En dos vasos de precipitados de 200 mL, colocar 50 mL de agua destilada y 2-3 mL de ácido clorhídrico sol. 1:3; en uno de los dos vasos disolver una punta de espátula de cloruro de estaño II (SnCl2), en el otro disolver otro tanto de cloruro de hierro III (FeCl3); luego verter el contenido de un vaso en el otro, agitando la solución resultante.
Por último, toma cuatro tubos de ensayo y vierte en cada uno 5 o 10 ml de la solución, procediendo al análisis cualitativo:
Primera parte: estudio del ion Sn2+:
Se toma uno de los tubos de ensayo y se añaden a la solución unas gotas de hidróxido de sodio sol. 1 M. Observar la formación de un precipitado gelatinoso blanco de hidróxido de estaño II (Sn(OH)2 ), según la reacción:
Al añadir unas gotas de hidróxido de amonio sol. 25 % se observa que el precipitado no se disuelve.
Segunda parte: investigación del ion Sn4+:
Prepara un poco de sulfuro de hidrógeno (H2S): coloca en un Erlenmeyer 2 trozos de sulfuro de hierro (FeS), añade 10 o 20 mL de agua destilada y 20 o 30 mL de sol de ácido clorhídrico. 37 %; cerrar el matraz con un tapón provisto de un tubo de desprendimiento y hacer burbujear el gas así producido en el segundo tubo de ensayo. En pocos segundos se observa la formación de un precipitado amarillo claro de sulfuro de estaño (SnS2), según la reacción:
Nota: Como el medio es ácido por el HCl, puede no formarse un precipitado marrón de sulfuro de estaño (SnS2); si esto sucede, añadir unas gotas más de ácido clorhídrico sol. 1:3.
Tercera parte: búsqueda del ion Fe2+:
Tomar el tercer tubo de ensayo que contiene la solución examinada y añadirle una punta de espátula de ferricianuro de potasio (K3Fe(CN)6) ; agitar y observar en poco tiempo la formación de un precipitado azulado de ferricianuro de hierro II (Fe3[Fe(CN)6]2 , llamado azul de Turnbull ), según la reacción:
Añadiendo unas gotas de ácido clorhídrico sol. 1:3 se observa que el precipitado no es soluble.
Cuarta parte: búsqueda del ion Fe3+:
Toma el último tubo y añade una punta de espátula de tiocianato de potasio (KCNS) a la solución; agita y observa la formación de un precipitado rojo sangre de tiocianato de hierro III (Fe(CNS)3), según la reacción:
La presencia simultánea de los iones buscados demuestra que la reacción se encuentra en equilibrio.
Después del experimento
Tabular los resultados cualitativos. Investigar cuales otras reacciones pueden investigarse con esta metodología y que reacciones se emplearían para determinar la presencia de cada especie.
Para más información Laboratory 7: Chemical Equilibrium
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-02-03). Verificación del equilibrio químico en una reacción. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/verificacion-del-equilibrio-quimico-en-una-reaccion/
ACS: . Verificación del equilibrio químico en una reacción. https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/verificacion-del-equilibrio-quimico-en-una-reaccion/. Fecha de consulta 2024-07-27.
IEEE: , "Verificación del equilibrio químico en una reacción," https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/verificacion-del-equilibrio-quimico-en-una-reaccion/, fecha de consulta 2024-07-27.
Vancouver: . Verificación del equilibrio químico en una reacción. [Internet]. 2021-02-03 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/verificacion-del-equilibrio-quimico-en-una-reaccion/.
MLA: . "Verificación del equilibrio químico en una reacción." https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/verificacion-del-equilibrio-quimico-en-una-reaccion/. 2021-02-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net