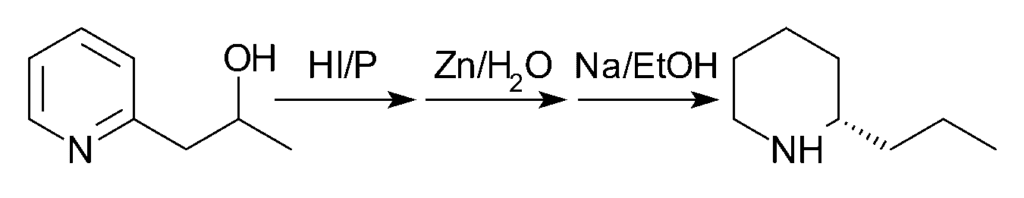Actualizado en abril 26, 2022
Tiempo de lectura estimado: 12 minutos
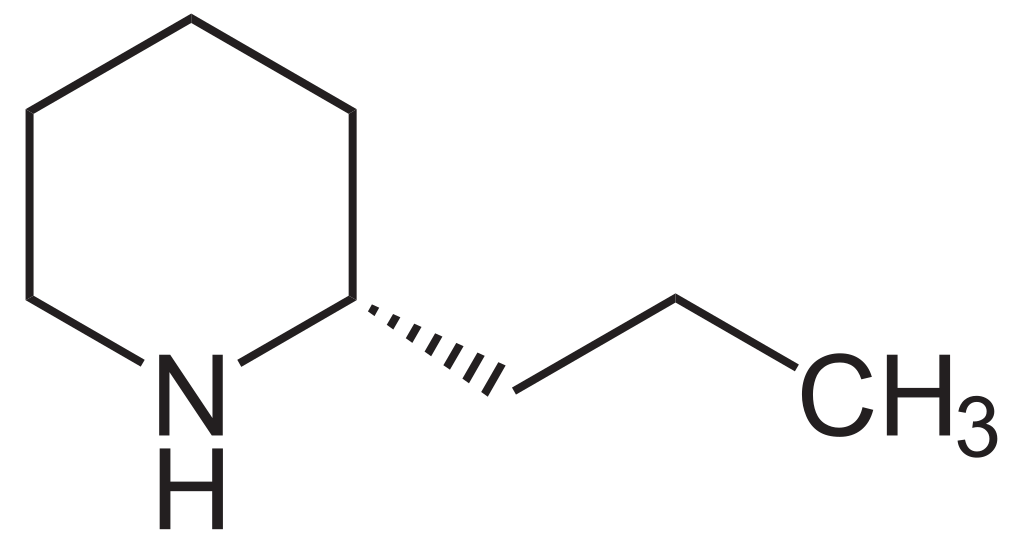
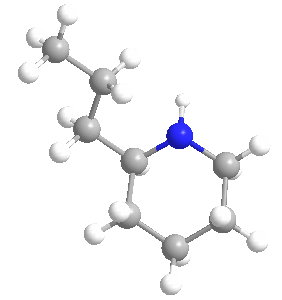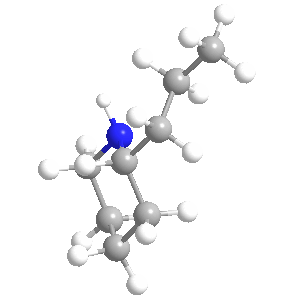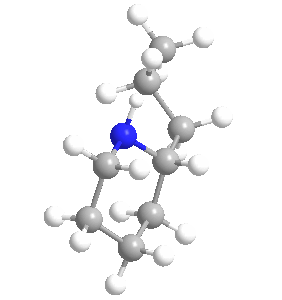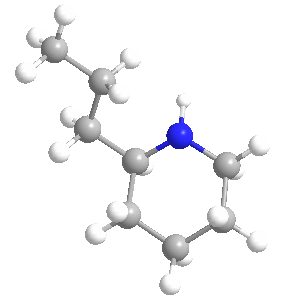
La coniína o Cicutina es un compuesto químico venenoso, un alcaloide presente en la cicuta venenosa (Conium maculatum) y aislado de ella, donde su presencia ha sido una fuente de gran interés económico, médico e histórico-cultural; la coniína también es producida por la planta de jarra amarilla (Sarracenia flava) y el perejil de los tontos (Aethusa cynapium).
Su ingestión y exposición prolongada son tóxicas para los seres humanos y para todas las clases de ganado; su mecanismo de envenenamiento implica la alteración del sistema nervioso central, con la muerte causada por la parálisis respiratoria. La biosíntesis de la coniína contiene como penúltimo paso la ciclización no enzimática de la 5-oxooctilamina a γ-coniceina, una base de Schiff que se diferencia de la coniína sólo por su doble enlace de carbono-nitrógeno en el anillo. Esta vía da como resultado el coniína natural que es una mezcla – un racemato – compuesto de dos enantiómeros, los estereoisómeros (S)-(+)-coniína y (R)-(-)-coniína, dependiendo de la dirección tomada por la cadena que se ramifica desde el anillo.
Ambos enantiómeros son tóxicos, siendo el (R)-enantiómero el más biológicamente activo y tóxico de los dos en general. La coniína ocupa un lugar en la historia de la química orgánica por ser la primera de la importante clase de alcaloides que se sintetizó, por Albert Ladenburg en 1886, y se ha sintetizado en el laboratorio de varias maneras únicas hasta los tiempos modernos.
El envenenamiento por cicuta ha sido una preocupación constante de los seres humanos, una preocupación veterinaria regular, y ha tenido importantes ocurrencias en la historia humana y cultural. En particular, en el año 399 a.C., Sócrates, cuando fue condenado a muerte, eligió morir bebiendo una mezcla de cicuta venenosa que contenía coniína.
Fuentes naturales de la coniína
La cicuta venenosa (Conium maculatum) contiene cantidades altamente tóxicas de coniína. Su presencia en las tierras de cultivo es un problema para los ganaderos porque los animales se la comerán si no están bien alimentados o si la cicuta se mezcla con pastos. La coniína está presente en el Conium maculatum como una mezcla de los antígenos R-(-)- y S-(+)-.
La coniína también se encuentra en la Sarracenia flava, la planta jarra amarilla. La planta jarra amarilla es una planta carnívora endémica del sudeste de los Estados Unidos. La planta utiliza una mezcla de azúcar y coniína para atraer y envenenar simultáneamente a los insectos, que luego caen en un tubo digestivo. La coniína también se encuentra en la Aethusa cynapium, comúnmente conocida como perejil de los tontos.
Historia de los extractos naturales de coniína
La historia de la coniína está comprensiblemente ligada a la planta de la cicuta venenosa, ya que el producto natural no fue sintetizado hasta la década de 1880. El envenenamiento de cicuta más famoso ocurrió en el año 399 a.C., cuando se cree que el filósofo Sócrates consumió un líquido mezclado con cicuta para llevar a cabo su sentencia de muerte, al haber sido condenado por impiedad hacia los dioses, y la corrupción de la juventud. El jugo de cicuta se usaba a menudo para ejecutar a los criminales en la antigua Grecia.
Farmacología y toxicología
El enantiómero (R)-(-) de la coniína es el más activo biológicamente, al menos en un sistema (células TE-671 que expresan los receptores neuromusculares nicotínicos del feto humano), y en el bioensayo con ratones, el mismo enantiómero y la mezcla racémica son aproximadamente el doble de tóxicos que el enantiómero (S)-(+) (véase más abajo).
La coniína, como racemato o como enantiómero puro, comienza por unir y estimular el receptor nicotínico en la membrana post-sináptica de la unión neuromuscular. La despolarización subsiguiente da como resultado la toxicidad nicotínica; como la coniína se mantiene unida al receptor, el nervio se mantiene despolarizado, inactivándolo. Esto da como resultado, de manera sistémica, una parálisis flácida, una acción similar a la del curare.
Los síntomas de la parálisis generalmente ocurren dentro de una media hora, aunque la muerte puede tomar varias horas. El sistema nervioso central no se ve afectado: la persona permanece consciente y consciente hasta que la parálisis respiratoria da como resultado el cese de la respiración. La parálisis muscular flácida es una parálisis ascendente, afectando primero a los miembros inferiores. La persona puede tener una convulsión hipóxica justo antes de la muerte, disfrazada por la parálisis muscular de tal manera que la persona puede temblar débilmente.
La causa de la muerte es la falta de oxígeno en el cerebro y el corazón como consecuencia de la parálisis respiratoria, por lo que una persona envenenada puede recuperarse si se puede mantener la ventilación artificial hasta que se elimine la toxina del sistema de la víctima.
Los valores de LD50 (en ratón, i.v. administrado) para los enantiómeros R-(-) y S-(+), y el racemato, son aproximadamente 7 y 12, y 8 miligramos por kilogramo, respectivamente.
Uso medico
La cicuta ha tenido un uso médico limitado a lo largo de la historia. Los griegos la usaron no sólo como pena capital, sino también como antiespasmódico y tratamiento para la artritis. Libros del siglo X atestiguan el uso médico de los anglosajones. En la Edad Media se creía que la cicuta se podía usar para curar la rabia; en tiempos europeos posteriores se llegó a asociar con ungüentos voladores en la brujería. Los nativos americanos usaban el extracto de cicuta como veneno para las flechas.
Mientras que la planta de jarra amarilla y el perejil de tonto también contienen coniína, no hay informes de usos tradicionales para estas plantas.
Propiedades químicas
La (+/-)-Coniína fue aislado primero por Giesecke, pero la fórmula fue sugerida por Blyth y establecida definitivamente por Hoffmann.
Desde entonces se ha determinado que la D-(S)-Coniína es un líquido alcalino incoloro, de olor penetrante y sabor ardiente; tiene D0° 0,8626 y D19° 0,8438, índice de refracción n23°D 1,4505, y es dextrorotatorio, [α]19°D +15,7°. La L-(R)-Coniina tiene [α]21°D 15° y en otros aspectos se asemeja a su isómero D, pero las sales tienen puntos de fusión ligeramente diferentes; el platinicloruro tiene mp. 160 °C (Löffler y Friedrich informan 175 °C), el auricloruro mp. 59 °C.
Solubilidad
La Coniína es ligeramente soluble (1 en 90) en agua fría, menos en agua caliente, por lo que una solución fría clara se vuelve turbia cuando se calienta. Por otro lado, la base disuelve alrededor del 25% del agua a temperatura ambiente. Se mezcla con el alcohol en todas las proporciones, es fácilmente soluble en el éter y en la mayoría de los disolventes orgánicos. La coniína se disuelve en disulfuro de carbono, formando un complejo tiocarbamato.
Cristalización
La Coniína se solidifica en una masa cristalina suave a -2 °C. Se oxida lentamente en el aire. Las sales se cristalizan bien y son solubles en agua o alcohol. El clorhidrato, B-HCl, se cristaliza en agua en rombos, mp. 220 °C, [α]20°D +10,1°; el bromuro de hidrógeno, en agujas, mp. 211 °C, y el tartrato de ácido D, B-C4H6O6-2H2O, en cristales rómbicos, mp. 54 °C.
El cloruro de platino, (B-HCl)2-PtCl4-H2O, se separa de la solución concentrada como un aceite, que se solidifica en una masa de cristales amarillo-naranja, mp. 175 °C (seco). El auricloruro, B-HAuCl4, se cristaliza al ponerse de pie, mp. 77 °C. El picrato forma pequeñas agujas amarillas, mp. 75 °C, a partir de agua caliente. Los derivados de 2,4-dinitrobenzoilo y 3,5-dinitrobenzoilo tienen mps. 139,0-139,5 °C y 108-9 °C respectivamente. El precipitado que proporciona la solución de yoduro de potasio y cadmio es cristalino, mp. 118 °C, mientras que el dado por la nicotina con este reactivo es amorfo.
Cambios de color
La Coniína no da ninguna coloración con ácido sulfúrico o nítrico. El nitroprusiato de sodio da un color rojo intenso, que desaparece al calentarse, pero reaparece al enfriarse, y es cambiado a azul o violeta por los aldehídos.
Rotación específica
La composición estereoquímica de la «coniína» es un asunto de cierta importancia, ya que sus dos enantiómeros no tienen propiedades biológicas idénticas, y muchos de los estudios farmacológicos más antiguos sobre este compuesto se realizaron utilizando la mezcla isomérica natural. La S-(+)-Coniína tiene una rotación específica, [α]D, de +8,4° (c = 4,0, en CHCl3).
Estos autores señalan que el valor de Ladenburg, +15°, es para una muestra «limpia», es decir, sin diluir. Un valor igualmente elevado de +16° para el [α]D de coniína se da, sin citar explícitamente la fuente, en el Índice de Merck. El valor de +7,7° (c = 4,0, CHCl3) para la S-(+)-coniína sintética y -7,9° (c = 0. 5, CHCl3) para la coniína R-(-)- sintética está dado por otros químicos. Las sales de cloruro de los enantiómeros (S)-(+) y (R)-(-) de la coniína tienen valores de [α]D de +4,6° y -5,2°, respectivamente (c = 0,5, en metanol).
Síntesis de la coniína
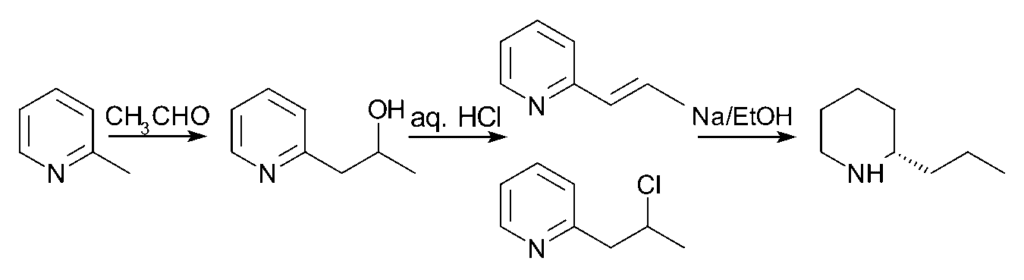
La síntesis original (que se muestra en el siguiente esquema) de la Coniína fue realizada por Ladenburg en 1886*. Ladenburg calentó una sal yodada de N-metilpiridina a 250 °C, obteniendo 2-metilpiridina. Luego realizó la condensación de Knoevenagel con acetaldehído en cloruro de zinc anhidro para obtener 2-propenilpiridina. De hecho, Ladenburg utilizó paraldehído, un trímero cíclico de acetaldehído que forma fácilmente acetaldehído al calentarse. Por último, la 2-propenilpiridina se redujo con sodio metálico en etanol para obtener coniína racémica (±). La cristalización fraccionada de coniína racémica con ácido (+)-tartárico produjo coniína enantiopura.
El plan propuesto por Ladenburg dio malos resultados, por lo que se abrió la búsqueda de rutas alternativas. Se observa un rendimiento ligeramente mejor si se calienta la 2-metilpiridina y el acetaldehído en un tubo sellado con ácido clorhídrico durante 10 horas. Se forma una mezcla de 2-metilpiridina y 2-cloropropilpiridina, que posteriormente se reduce con sodio en etanol para dar rac-coniína.
Nota: aunque el esquema que figura a continuación muestra un solo enantiómero de la coniína, la reacción final produce una mezcla racémica que luego se separa
En 1907, se propuso otra ruta con mejor rendimiento. En primer lugar, la 2-(2′-hidroxipropil)piridina se reduce con el fósforo y el ácido clorhídrico fumante a 125 °C. En segundo lugar, el producto se trata con polvo de zinc y agua. Finalmente, el producto del segundo paso se trata con sodio en etanol.
Nota: aunque el esquema siguiente muestra un solo enantiómero de coniína, la reacción final produce una mezcla racémica que luego se separa
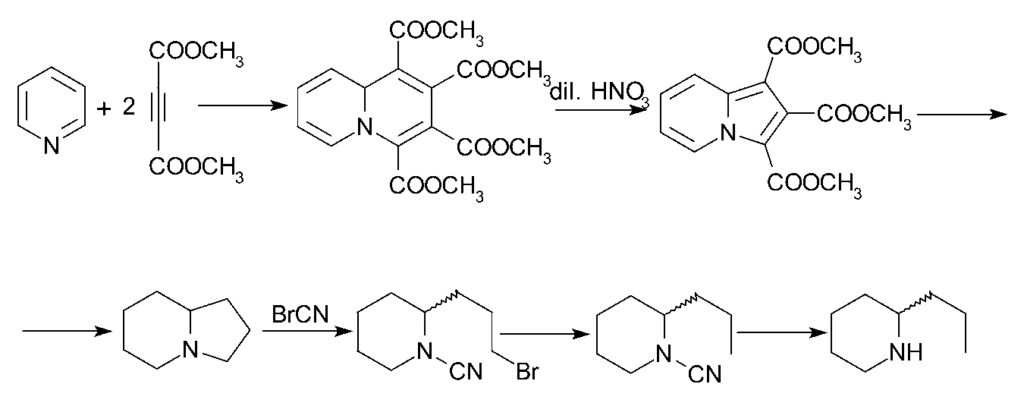
Se han efectuado otras síntesis de coniína, de las cuales la de Diels y Alder es de especial interés. El aducto inicial de piridina y dimetil acetilendiocarboxilato es la tetrametilquinolizina-1,2,3,4-tetracarboxilato, que al oxidarse con ácido nítrico diluido se convierte en trimetil indolizina-tricarboxilato. Éste, por hidrólisis y descarboxilación, proporciona indolizina, cuyo octahidro-derivado, también conocido como octahidropirrocolina se convierte por el método del bromuro de cianógeno sucesivamente en bromocianamida, cianoamida y rac. Una síntesis del alcaloide, a partir de la indolizina (pirrocolina) es descrita por Ochiai y Tsuda.
La preparación de L-(R)-coniína mediante la reducción de β-coniceína (L-propenilpiperidina) por Löffler y Friedrich proporciona medios para convertir la conidrina en L-(R)-coniína. Hess y Eichel informaron, incorrectamente, que la peletierina era el aldehído (β-2-piperidil-propaldehído) correspondiente a la coniína, y que producía rac-coniína cuando su hidracina se calentaba con etóxido de sodio en etanol a 156-170 °C. Según estos autores, la D-(S)-coniína se vuelve casi ópticamente inactiva cuando se calienta con hidróxido de bario y alcohol a 180-230 °C. Leithe ha demostrado mediante la observación de la rotación óptica del ácido (+)-pipecólico (piperidina-2-ácido carboxílico) y algunos de sus derivados en condiciones variables, que debe pertenecer a la serie D de aminoácidos.
Actualmente, la Coniína, y muchos otros alcaloides, pueden ser sintetizados estereoselectivamente. Por ejemplo, la reacción de transferencia de quiralidad 1,3 catalizada por Pd puede transformar estereoespecíficamente un solo enantiómero de un alcohol alílico en una estructura cíclica (en este caso una piperidina). De esta manera, a partir del alcohol (S) se obtiene un enantiómero (S) de la Coniina y viceversa. Sorprendentemente, la separación del alcohol racémico en diferentes enantiómeros se hace con la ayuda de la lipasa de la Cándida antártica.
Curiosidades
La coniína es el arma homicida de la novela de misterio de Agatha Christie «Cinco cerditos» (Five Little Pigs).
Los estereoisómeros de propilpiperidina R y S 2 son una neurotoxina presente en una forma de vida similar a la de una babosa en La Expansión. La toxina se muestra como causante de la muerte casi instantánea al contacto con la piel en el programa.
Para más información Coniine – a piperidine alkaloid
* Ladenburg, A. (1886-01-01). «Versuche zur Synthese des Coniin». Berichte der Deutschen Chemischen Gesellschaft. 19 (1): 439–441. doi:10.1002/cber.188601901108. ISSN 0365-9496.
Como citar este artículo:
APA: (2021-11-09). Coniína. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/coniina/
ACS: . Coniína. https://quimicafacil.net/compuesto-de-la-semana/coniina/. Fecha de consulta 2024-07-27.
IEEE: , "Coniína," https://quimicafacil.net/compuesto-de-la-semana/coniina/, fecha de consulta 2024-07-27.
Vancouver: . Coniína. [Internet]. 2021-11-09 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/coniina/.
MLA: . "Coniína." https://quimicafacil.net/compuesto-de-la-semana/coniina/. 2021-11-09. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net