Tiempo de lectura estimado: 7 minutos
El catalizador de Wilkinson es el nombre común para el cloruro de tris(trifenilfosfina)rodio(I), un complejo de coordinación de rodio con la fórmula [RhCl(PPh3)3], donde ‘Ph’ denota un grupo fenilo. Es un sólido de color rojo-marrón que es soluble en solventes hidrocarbonados como el benceno, y más aún en tetrahidrofurano o solventes clorados como el diclorometano.
El compuesto se utiliza ampliamente como catalizador para la hidrogenación de alquenos. Recibe su nombre del químico y premio Nobel Sir Geoffrey Wilkinson, quien popularizó su uso por primera vez.
Históricamente, el catalizador de Wilkinson ha sido un paradigma en estudios catalíticos que han llevado a varios avances en el campo, como la implementación de algunos de los primeros estudios de resonancia magnética nuclear heteronuclear para su elucidación estructural en solución (31P), la espectroscopía de polarización inducida por parahidrógeno para determinar la naturaleza de las especies reactivas transitorias, o una de las primeras investigaciones cinéticas detalladas de Halpern para elucidar el mecanismo.
Además, los estudios catalíticos y organometálicos sobre el catalizador de Wilkinson también jugaron un papel significativo en el desarrollo posterior de los catalizadores de transferencia de hidrogenación asimétrica basados en Rh y Ru cationes, sentando las bases para la catálisis asimétrica moderna.
Historia del catalizador de Wilkinson
El descubrimiento fortuito del catalizador de Wilkinson ocurrió a mediados de la década de 1960 a través de los esfuerzos experimentales de Fred Jardine, un candidato a doctorado bajo la tutela de Sir Geoffrey Wilkinson. El objetivo principal de Jardine era la síntesis del complejo octaédrico triclorotris-trifenilfosfina rodio(III), RhCl3(PPh3)3. Este proceso implicaba someter el trihidrato de rodio(III) a un exceso de trifenilfosfina en ebullición de etanol.
Inesperadamente, el resultado produjo consistentemente el complejo de rodio(I) plano-cuadrado RhCl(PPh3)3. Esta desviación del producto previsto se originó en el exceso de fosfina que actuaba como un agente reductor potente. La transformación catalítica se produjo a medida que la especie de rodio transitaba de la configuración electrónica d6 característica del rodio(III) a la configuración d8 asociada con el rodio(I), según la siguiente reaccion:
El RhCl(PPh3)3 es generalmente un sólido cristalino de color rojo oscuro, aunque a veces se obtienen cristales de color anaranjado. En 1977, Bennett y Donaldson reportaron la estructura de rayos X de ambos compuestos polimórficos.
Estudios sobre las características del catalizador de Wilkinson
La primera característica informada respecto al compuesto RhCl(PPh3)3 fue su capacidad catalítica en la hidrogenación de olefinas. Su destacada actividad y selectividad en un entorno homogéneo lo mantienen actualizado y disponible comercialmente como reactivo para síntesis química, con números de referencia específicos (a) Chemical Abstracts (CAS): 14694-95-2; (b) Aldrich: 20,503-6; (c) Merck Index: 12,2226; (d) Strem 45-0650).
Es esencial destacar que, a mediados de la década de 1960, las fosfinas emergieron como ligandos de gran interés en la química de coordinación, especialmente por las propiedades que podían conferir a los complejos de metales de transición. Los ligandos, en términos generales, aportan características estéricas y electrónicas beneficiosas al emplearse en compuestos de coordinación como catalizadores, especialmente en catálisis homogénea.
Esto generó un fuerte interés entre los químicos inorgánicos por explorar las posibilidades que las fosfinas podían ofrecer. La trifenilfosfina, P(C6H5)3, se destaca como un ligando fosforado con propiedades donadoras σ y aceptoras π. Dada su asociación con los fosfitos (P(OR)3) y su pertenencia al grupo 15 de la tabla periódica, comparte relaciones en su química de coordinación con arsinas (AsR3), estibinas (SbR3) y bismutinas (BiR3).
La capacidad de una fosfina para actuar como donador σ o aceptor π está influenciada por los grupos sustituyentes. Grupos alquilo (R = alquilo) la convierten en un donador σ eficiente pero un pobre aceptor π, mientras que sustituyentes halógenos como el grupo fluoruro resultan en una PF3 que es un deficiente donador σ pero un aceptable aceptor π, comparable al CO.
En las fosfinas de tipo PR3, el impedimento estérico está estrechamente vinculado a la naturaleza del grupo alquilo sustituyente. Así, la trifenilfosfina, PPh3, o la triterbutilfosfina, PtBu3, presentan un impedimento estérico significativamente mayor que la trimetilfosfina, PMe3, o la trietilfosfina, PEt3.
Cono de Tolman
La evaluación del impedimento estérico en las fosfinas se lleva a cabo mediante el ángulo de cono de Tolman, que considera la fosfina enlazada o coordinada a un centro metálico. En este contexto, el «cono» tiene su origen (vértice) en el átomo metálico y abarca, por ejemplo, a la PPh3, tomando como límite la superficie de van der Waals de los hidrógenos de fenilo.
En función del ángulo de cono de Tolman exhibido por la fosfina, se determinará la propensión al ingreso de sustratos en la esfera del complejo metálico. Este factor desempeñará un papel crucial en la modulación de la reactividad del sistema cuando el complejo M(PR3)n funge como catalizador homogéneo, tal como se observa en la actividad catalítica del catalizador de Wikinson.
En las reacciones de hidrogenación, que son paradigmáticas para RhCl(PPh3)3, el cloruro opera como ligando espectador, mientras que las trifenilfosfinas experimentan la necesidad de ingresar y salir de la esfera de coordinación. Esto facilita la adición oxidativa del hidrógeno, la coordinación del sustrato y, finalmente, la eliminación reductiva del producto.
La labilidad de la fosfina, opuesta al cloruro, en el catalizador de Wilkinson, se ajusta de manera coherente al «efecto trans». En este contexto, la naturaleza intrínseca de la fosfina, así como los efectos estéricos y electrónicos, ejercen un papel determinante en los procesos de hidrogenación catalítica de los sustratos.
El cloruro presente en la esfera de coordinación del catalizador de Wilkinson se origina a partir de RhCl3•3H2O, sirviendo como punto de partida en la síntesis del complejo. Este cloruro actúa como orientador del «efecto trans», superando a la PPh3 en su capacidad direccional. Por lo tanto, a lo largo del ciclo de hidrogenación catalítica, el cloruro mantiene su carácter labilizador en la posición trans-, facilitando la salida de la fosfina y promoviendo la entrada del solvente.
Síntesis y aplicaciones
El catalizador de Wilkinson suele obtenerse tratando el cloruro de rodio(III) hidratado con un exceso de trifenilfosfina en etanol en ebullición. La trifenilfosfina actúa como un ligando y un agente reductor de dos electrones que se oxida a sí misma desde el estado de oxidación (III) a (V). En la síntesis, tres equivalentes de trifenilfosfina se convierten en ligandos en el producto, mientras que el cuarto reduce el rodio(III) a rodio(I).
Aplicaciones
El catalizador de Wilkinson es más conocido por catalizar la hidrogenación de olefinas con hidrógeno molecular. El mecanismo de esta reacción implica la disociación inicial de uno o dos ligandos de trifenilfosfina para dar complejos de 14 o 12 electrones, respectivamente, seguido de la adición oxidativa de H2 al metal.
La π-complejación subsiguiente del alqueno, la inserción migratoria (transferencia intramolecular de hidruro o inserción de olefina) y la eliminación reductora completan la formación del producto alcano, por ejemplo:
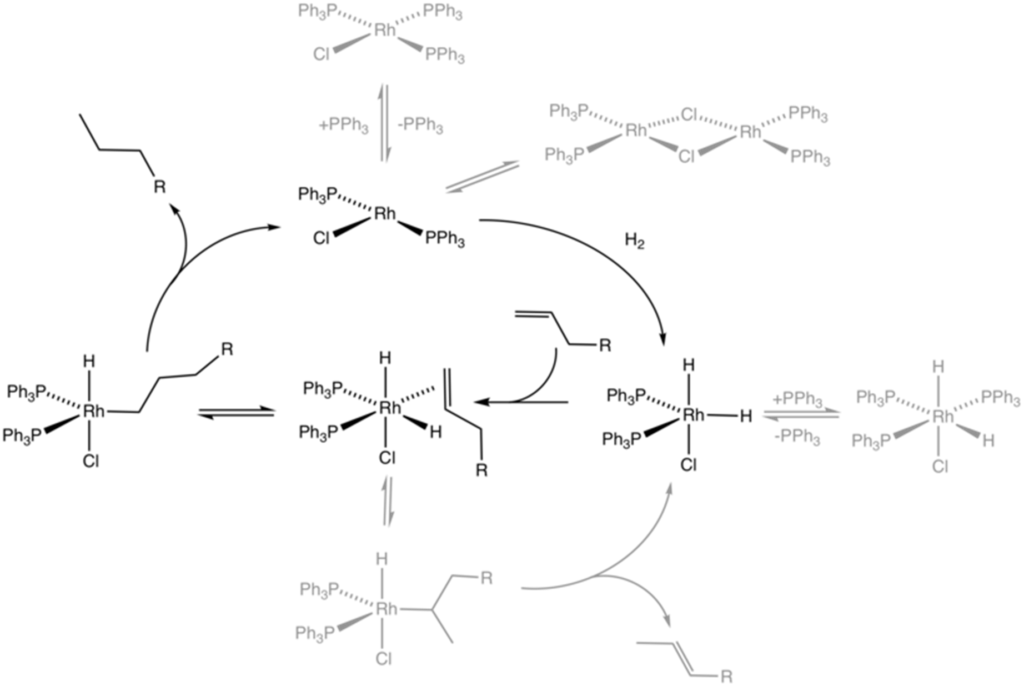
En términos de sus tasas de hidrogenación, el grado de sustitución en el sustrato de olefina es el factor clave, ya que el paso limitante en la velocidad es la inserción en la olefina, que está limitada por la severa interferencia estérica alrededor del centro metálico.
En la práctica, las alquenos terminales y disustituidos son buenos sustratos, pero los alquenos más impedidos son más lentos para hidrogenarse. La hidrogenación de alquinos es difícil de controlar, ya que los alquinos tienden a reducirse a alcanos, a través de la intermediación del alqueno cis. El etileno reacciona con el catalizador de Wilkinson para dar RhCl(C2H4)(PPh3)2, pero no es un sustrato para la hidrogenación.
Para más información Transformando la catálisis homogénea: cincuenta años del catalizador de Wilkinson
Como citar este artículo:
APA: (2024-02-13). Catalizador de Wilkinson. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-wilkinson/
ACS: . Catalizador de Wilkinson. https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-wilkinson/. Fecha de consulta 2024-07-27.
IEEE: , "Catalizador de Wilkinson," https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-wilkinson/, fecha de consulta 2024-07-27.
Vancouver: . Catalizador de Wilkinson. [Internet]. 2024-02-13 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-wilkinson/.
MLA: . "Catalizador de Wilkinson." https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-wilkinson/. 2024-02-13. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net

