Tiempo de lectura estimado: 11 minutos
Un paso clave después de llevar a cabo una reacción en el laboratorio es la purificación de los productos obtenidos.
El trabajo se refiere a los métodos destinados a purificar el material, y lo más habitual es que se realice en un embudo de separación. Se añaden soluciones al embudo para extraer o lavar la mezcla, con el objetivo de aislar el producto del exceso de reactivos, catalizadores, productos secundarios, disolventes o compuestos formados por reacciones secundarias.
Agentes de lavado comunes
Agua
El lavado más común en los embudos separadores es probablemente el agua. El agua es barata, no es peligrosa y funciona bien para eliminar las impurezas que se encuentran junto al producto deseado.
El agua puede eliminar potencialmente las impurezas solubles en agua de una capa orgánica, siempre que estén presentes en cantidades que no excedan su solubilidad en agua. Los siguientes son materiales comunes que pueden eliminarse con un lavado con agua: ácido o base no consumidos, muchas sales iónicas y compuestos que pueden formar enlaces de hidrógeno con el agua (tienen un átomo de oxígeno o nitrógeno) y son relativamente pequeños (por ejemplo, CH3CH2OH o CH3COCH3).
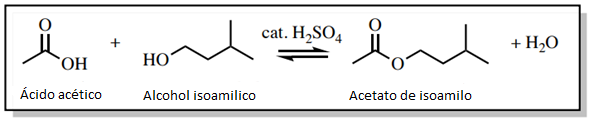
Para demostrar la eficacia de un lavado con agua, se llevó a cabo una reacción de esterificación de Fischer para producir acetato de isoamilo (Figura 1). En esta reacción, se utiliza un exceso de ácido acético para impulsar la reacción mediante el principio de Le Chatelier, y el ácido acético tuvo que ser eliminado del producto durante el proceso de purificación.
El espectro de RMN 1H de la figura 2a se tomó de la mezcla de reacción inmediatamente después de cesar el calentamiento y antes del trabajo. Como se esperaba, se observa una señal significativa para el ácido acético a 2,097ppm.

A continuación, la reacción se lavó vertiendo la mezcla de reacción en un embudo de separación y lavando la capa orgánica con agua, bicarbonato sódico y salmuera sucesivamente. El objetivo principal del lavado con agua era eliminar la mayor parte del ácido sulfúrico catalítico y el exceso de ácido acético, mientras que el lavado con bicarbonato sódico neutralizaba el resto. El espectro de RMN 1H del producto final (Figura 2b) mostró que los lavados fueron efectivos, ya que la señal de ácido acético a 2,097ppm está ausente.
El lavado con bicarbonato de sodio en este ejemplo fue necesario (y se discute en la siguiente sección) porque un lavado con agua por sí solo puede no eliminar completamente el ácido acético. Es importante saber que cuando un compuesto es «soluble en agua» no significa necesariamente que sea «insoluble orgánicamente», un error común que surge del principio de «lo semejante se disuelve en lo semejante».
Por ejemplo, el ácido acético tiene un K de 0,5 cuando se reparte entre el éter dietílico y el agua, lo que significa que el ácido acético favorece la capa acuosa sólo dos veces más que la capa orgánica.4 No debe ignorarse la capacidad del ácido acético y de otros compuestos polares para disolverse en la capa orgánica de un embudo de separación.
Bicarbonato de sodio y carbonato de sodio
Una parte normal de muchos trabajos incluye la neutralización. Es importante neutralizar cualquier disolvente orgánico que haya sido expuesto a una solución ácida o básica, ya que las trazas de ácido o base pueden provocar reacciones no deseadas cuando las soluciones se concentran. Asimismo, las muestras destinadas al análisis por CG deben ser neutras, ya que las soluciones ácidas degradan el revestimiento polimérico de la columna de CG. Además, es preferible manipular materiales neutros en lugar de ácidos o básicos, ya que así los derrames son menos peligrosos.
Las soluciones acuosas de bicarbonato sódico saturado (NaHCO3) y de carbonato sódico (Na2CO3) son básicas, y el objetivo de estos lavados es neutralizar una capa orgánica que pueda contener trazas de componentes ácidos. Aunque, en teoría, una capa orgánica no debería disolver componentes muy polares como el ácido, éste a veces se «engancha» a componentes polares que pueden disolverse en una capa orgánica, como pequeñas cantidades de alcoholes o agua.
Las siguientes reacciones se producen entre el ion bicarbonato (1), el ion carbonato (2) y el ácido (H+) durante un lavado:
El producto inicial de la reacción (1) es el ácido carbónico (H2CO3), que está en equilibrio con el agua y el gas carbónico. Esto significa que las soluciones de bicarbonato suelen burbujear durante un lavado de neutralización en un embudo de separación. El producto de la reacción (2) es el ion bicarbonato, que posteriormente puede sufrir la reacción (1). Esto significa que las soluciones de ion carbonato también suelen burbujear durante las neutralizaciones.
Nota de seguridad
Para evitar que se genere un exceso de presión por la liberación de gas de dióxido de carbono en un embudo de separación durante la neutralización, las capas deben agitarse suavemente antes de colocar el tapón. Deben ventilarse directamente después de la inversión, y con más frecuencia de lo habitual. La figura 3 muestra una capa orgánica fuertemente ácida (arriba) en contacto con una solución acuosa de bicarbonato sódico al 10% (abajo). Se observa una vigorosa corriente de burbujas que se origina en una pequeña porción de capa orgánica atrapada en el fondo del embudo. El burbujeo fue aún más vigoroso cuando se mezclaron las capas.
Comprobar el pH después de un lavado
Para comprobar si un lavado de base con NaHCO3 o Na2CO3 fue eficaz para eliminar todo el ácido de una capa orgánica, es útil comprobar el pH. No es posible probar el pH de una solución orgánica directamente, sin embargo, es posible probar el pH de una solución acuosa con la que la solución orgánica ha estado en contacto.
Si la capa acuosa se encuentra en la parte superior de un embudo de separación, introduzca una varilla de vidrio para agitar en la capa superior y toque con la varilla húmeda el papel tornasol azul. Una solución ácida hace que el papel tornasol azul se vuelva rosa (o rojo), mientras que una solución neutra o básica sólo da al papel tornasol azul un aspecto «húmedo» oscurecido (figura 4d). Si el papel tornasol se vuelve rosa en absoluto el lavado con base no ha neutralizado completamente la capa orgánica, y se necesitan posteriores lavados con base.
Si la capa acuosa se encuentra en el fondo del embudo de separación, pruebe una «alícuota» de la capa acuosa (o una pequeña muestra) en papel tornasol mediante el siguiente método:

- Con un dedo colocado sobre una pipeta de vidrio, introduzca la pipeta en el embudo de separación de forma que la punta se sitúe en la capa acuosa inferior (Figura 4a).
- Retire el dedo de la pipeta para permitir que una muestra de la capa acuosa entre en la pipeta por acción capilar (Figura 4b).
- Con un dedo colocado de nuevo sobre la pipeta de vidrio, retire la pipeta del embudo de separación. Debe quedar un poco de líquido en la punta de la pipeta, una alícuota de la capa inferior (Figura 4c).
- Toque la alícuota con papel tornasol azul y observe el color (Figura 4d).
- Si el papel tornasol se vuelve rosado, el lavado de la base no ha neutralizado completamente la capa orgánica, y se necesitan lavados posteriores de la base.
Salmuera (NaCl saturado)
En algunos experimentos, una capa orgánica puede lavarse con salmuera, que es una solución saturada de NaCl(aq). El propósito de este lavado es eliminar grandes cantidades de agua que puedan estar disueltas en la capa orgánica. Aunque la capa orgánica siempre debe exponerse posteriormente a un agente secante (por ejemplo, sulfato de sodio anhidro, sulfato de magnesio o cloruro de calcio), estos reactivos sólo eliminan, en el mejor de los casos, pequeñas cantidades de agua.
Los disolventes orgánicos que requieren un lavado con salmuera antes de la exposición a un agente de secado sólido son el éter dietílico y el acetato de etilo. Estos disolventes disuelven grandes cantidades de agua en comparación con otros disolventes (Tabla 1).
| Solvente | Gramos de agua disueltos en 100 mL de disolvente |
| Éter dietílico | 1.24 g |
| Acetato de etilo | 2.92 g |
| Diclorometano | 0.32 g |
| Hexanos | 0.007 g |
La salmuera funciona para eliminar el agua de una capa orgánica porque está muy concentrada (ya que el NaCl es muy soluble en agua). Una solución saturada de NaCl(aq) está muy ordenada, lo que provoca una gran motivación para que el agua entre en la solución desde la capa orgánica para aumentar la entropía de la solución salina (para diluir la solución).
La figura 5 muestra una diferencia cualitativa en la cantidad de agua presente en una capa orgánica con y sin el uso de un lavado de salmuera. El acetato de etilo se agitó con agua (Figura 5a) y luego se secó con una porción de MgSO4 anhidro.
Los grandes grumos de agente secante en la Figura 5b indican que esta capa de acetato de etilo todavía está notablemente húmeda. A continuación, el acetato de etilo se agitó con salmuera (Figura 5c) y se secó con la misma cantidad de MgSO4 anhidro. En esta capa de acetato de etilo hay poca aglomeración del agente secante y se observan partículas finas (Figura 5d), lo que significa que esta capa contenía muy poca agua.

Si se utilizan agentes de secado para eliminar el agua, cabe preguntarse: «¿Por qué molestarse con la salmuera; por qué no utilizar mucho agente de secado cuando llegue el momento?» La razón principal para limitar la cantidad de agua presente en una solución orgánica antes del paso del agente de secado es que el agente de secado suele adsorber el compuesto junto con el agua. Utilizar la menor cantidad posible maximizará el rendimiento.
Para demostrarlo, la Figura 6 muestra una solución de acetato de etilo que tiene un tenue tinte rosa porque contiene algún colorante alimentario rojo disuelto.
blanco anhidro, y el agente secante se volvió rosa al adsorber el compuesto de colorante alimentario rojo (Figura 6a). La adición de más MgSO4 anhidro hizo que el agente secante se volviera más rosa (Figura 6b), ya que se eliminó más colorante de la solución. En este ejemplo, incluso después de filtrar y enjuagar el agente desecante con más disolvente, el agente desecante siguió siendo rosa (Figura 6c). Por lo tanto, cuanto más agente secante se utilice, más compuesto puede perderse irremediablemente.

Para más información 4.7: Reaction Work-Ups
Como citar este artículo:
APA: (2022-02-02). Lavado de productos de reacción. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/lavado-de-productos-de-reaccion/
ACS: . Lavado de productos de reacción. https://quimicafacil.net/tecnicas-de-laboratorio/lavado-de-productos-de-reaccion/. Fecha de consulta 2026-02-14.
IEEE: , "Lavado de productos de reacción," https://quimicafacil.net/tecnicas-de-laboratorio/lavado-de-productos-de-reaccion/, fecha de consulta 2026-02-14.
Vancouver: . Lavado de productos de reacción. [Internet]. 2022-02-02 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/lavado-de-productos-de-reaccion/.
MLA: . "Lavado de productos de reacción." https://quimicafacil.net/tecnicas-de-laboratorio/lavado-de-productos-de-reaccion/. 2022-02-02. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net