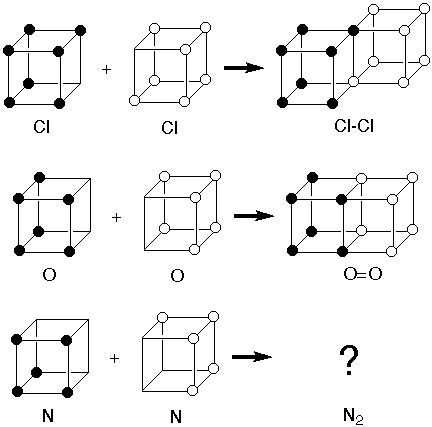
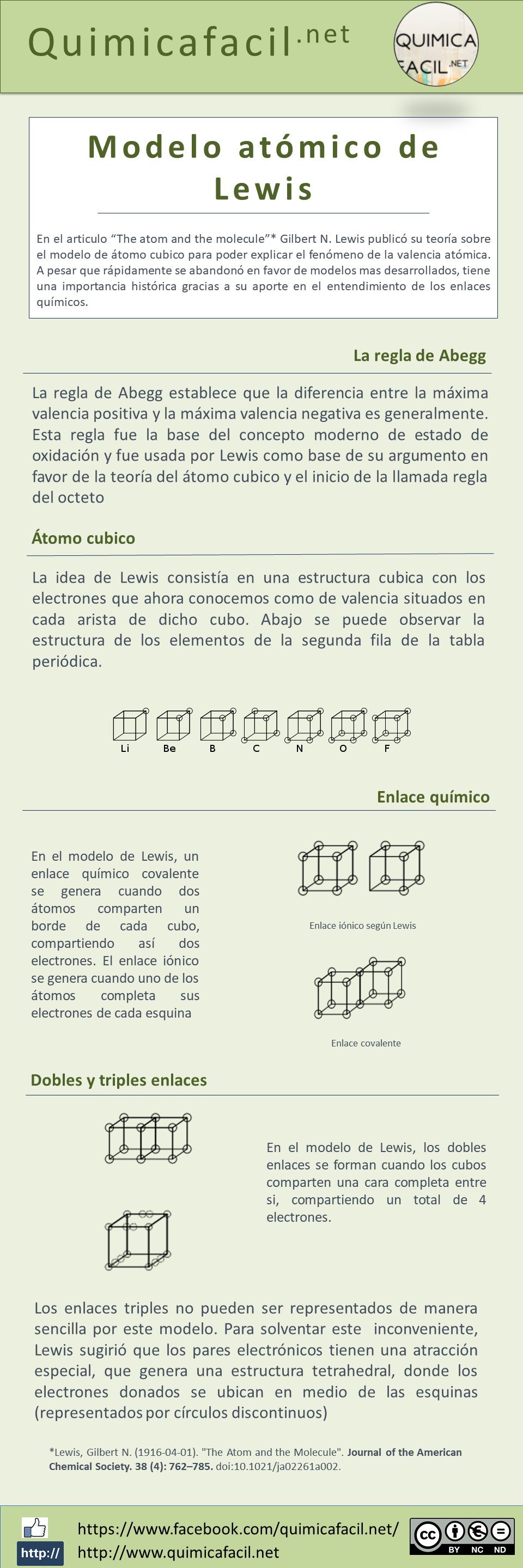
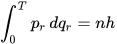Tiempo de lectura estimado: 6 minutos
El modelo de Bohr o modelo de Rutherford – Bohr, presentado por Niels Bohr y Ernest Rutherford en 1913, es un sistema que consiste en un pequeño y denso núcleo rodeado de electrones en órbita, similar a la estructura del Sistema Solar, pero con la atracción que proporcionan las fuerzas electrostáticas en lugar de la gravedad.
Después del modelo cúbico (1902), el modelo de pudín de ciruelas (1904), el modelo saturniano (1904), y el modelo Rutherford (1911) vino el modelo Rutherford-Bohr o simplemente el modelo Bohr para abreviar (1913).
Mejora al modelo de Rutherford
La mejora del modelo de Rutherford es sobre todo una interpretación física cuántica del mismo. El éxito clave del modelo radica en la explicación de la fórmula de Rydberg para las líneas de emisión espectral del hidrógeno atómico. Aunque la fórmula de Rydberg se había conocido experimentalmente, no obtuvo un fundamento teórico hasta que se introdujo el modelo de Bohr. El modelo de Bohr no sólo explicó las razones de la estructura de la fórmula de Rydberg, sino que también proporcionó una justificación para las constantes físicas fundamentales que constituyen los resultados empíricos de la fórmula.
El modelo de Bohr es un modelo relativamente primitivo del átomo de hidrógeno, comparado con el modelo del átomo de valencia. Como teoría, puede derivarse como una aproximación de primer orden del átomo de hidrógeno utilizando la mecánica cuántica más amplia y mucho más precisa y, por lo tanto, puede considerarse una teoría científica obsoleta.
Sin embargo, debido a su simplicidad y a sus resultados correctos para sistemas seleccionados, el modelo de Bohr se sigue enseñando comúnmente para introducir a los estudiantes en la mecánica cuántica o en los diagramas de niveles de energía antes de pasar al átomo de valencia más preciso, pero más complejo. Un modelo relacionado fue propuesto originalmente por Arthur Erich Haas en 1910 pero fue rechazado.
La teoría cuántica del período entre el descubrimiento de Planck del cuanto (1900) y el advenimiento de una mecánica cuántica madura (1925) se denomina a menudo la antigua teoría cuántica.
Origen del modelo de Bohr
A principios del siglo XX, los experimentos de Ernest Rutherford establecieron que los átomos consistían en una nube difusa de electrones cargados negativamente que rodeaba un pequeño y denso núcleo cargado positivamente. Dados estos datos experimentales, Rutherford consideró naturalmente un modelo planetario del átomo, el modelo de Rutherford de 1911 – electrones que orbitan un núcleo solar – sin embargo, dicho modelo planetario del átomo tiene una dificultad técnica: las leyes de la mecánica clásica (es decir, la fórmula de Larmor) predicen que el electrón liberará radiación electromagnética mientras órbita un núcleo.
Debido a que el electrón perdería energía, se movería rápidamente en espiral hacia el interior, colapsando en el núcleo en una escala de tiempo de alrededor de 16 picosegundos. Este modelo de átomo es desastroso, porque predice que todos los átomos son inestables.
Además, a medida que el electrón se mueve en espiral hacia adentro, la emisión aumentaría rápidamente en frecuencia a medida que la órbita se hiciera más pequeña y rápida. Esto produciría una emisión continua, en frecuencia, de radiación electromagnética. Sin embargo, los experimentos de finales del siglo XIX con las descargas eléctricas han demostrado que los átomos sólo emitirán luz (es decir, radiación electromagnética) a ciertas frecuencias discretas.
Postulados del modelo de Bohr
Para superar esta dura dificultad, Niels Bohr propuso, en 1913, lo que ahora se llama el modelo Bohr del átomo. Presentó estos tres postulados que resumen la mayor parte del modelo:
- El electrón es capaz de girar en ciertas órbitas estables alrededor del núcleo sin irradiar ninguna energía, al contrario de lo que sugiere el electromagnetismo clásico. Estas órbitas estables se llaman órbitas estacionarias y se alcanzan a ciertas distancias discretas del núcleo. El electrón no puede tener ninguna otra órbita entre las discretas.
- Las órbitas estacionarias se alcanzan a distancias para las cuales el momento angular del electrón giratorio es un múltiplo integral de la constante reducida de Planck: mevr=nħ , donde n = 1, 2, 3, … se llama el número cuántico principal, y ħ = h/2π. El valor más bajo de n es 1; esto da un radio orbital lo más pequeño posible de 0,0529 nm conocido como el radio de Bohr. Una vez que un electrón está en esta órbita más baja, no puede acercarse más al protón. A partir de la regla cuántica del momento angular, Bohr pudo calcular las energías de las órbitas permitidas del átomo de hidrógeno y de otros átomos y iones similares al hidrógeno. Estas órbitas se asocian con energías definidas y también se denominan conchas de energía o niveles de energía. En estas órbitas, la aceleración de los electrones no resulta en radiación y pérdida de energía. El modelo Bohr de un átomo se basaba en la teoría cuántica de la radiación de Planck.
- Los electrones sólo pueden ganar y perder energía saltando de una órbita permitida a otra, absorbiendo o emitiendo radiación electromagnética con una frecuencia ν determinada por la diferencia de energía de los niveles según la relación de Planck: Δ E = E2 – E1 = hν, donde h es la constante de Planck.
Otros postulados anexos son:
- Como la teoría de Einstein sobre el efecto fotoeléctrico, la fórmula de Bohr asume que durante un salto cuántico se irradia una cantidad discreta de energía. Sin embargo, a diferencia de Einstein, Bohr se apegó a la clásica teoría de Maxwell sobre el campo electromagnético. La cuantificación del campo electromagnético se explicó por la discreción de los niveles de energía atómica; Bohr no creía en la existencia de fotones.
- Según la teoría de Maxwell, la frecuencia ν de la radiación clásica es igual a la frecuencia de rotación νrot del electrón en su órbita, con armónicos en múltiplos enteros de esta frecuencia. Este resultado se obtiene a partir del modelo de Bohr para saltos entre los niveles de energía En y En-k cuando k es mucho menor que n. Estos saltos reproducen la frecuencia del armónico k-ésimo de la órbita n. Para valores suficientemente grandes de n (los llamados estados de Rydberg), las dos órbitas involucradas en el proceso de emisión tienen casi la misma frecuencia de rotación, de modo que la frecuencia orbital clásica no es ambigua. Pero para la pequeña n (o la gran k), la frecuencia de radiación no tiene una interpretación clásica inequívoca. Esto marca el nacimiento del principio de correspondencia, que requiere que la teoría cuántica esté de acuerdo con la teoría clásica sólo en el límite de los grandes números cuánticos.
- La teoría Bohr-Kramers-Slater (teoría BKS) es un intento fallido de extender el modelo de Bohr, que viola la conservación de la energía y el impulso en los saltos cuánticos, con las leyes de conservación sólo se mantienen en promedio.
Para más información Evolution of Atomic Theory
Como citar este artículo:
APA: (2018-05-24). Modelo atómico de Bohr. Recuperado de https://quimicafacil.net/infografias/modelo-atomico-de-bohr/
ACS: . Modelo atómico de Bohr. https://quimicafacil.net/infografias/modelo-atomico-de-bohr/. Fecha de consulta 2026-03-03.
IEEE: , "Modelo atómico de Bohr," https://quimicafacil.net/infografias/modelo-atomico-de-bohr/, fecha de consulta 2026-03-03.
Vancouver: . Modelo atómico de Bohr. [Internet]. 2018-05-24 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/infografias/modelo-atomico-de-bohr/.
MLA: . "Modelo atómico de Bohr." https://quimicafacil.net/infografias/modelo-atomico-de-bohr/. 2018-05-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net