Tiempo de lectura estimado: 8 minutos
Un mecanismo de reacción puede ser estudiado a través de una técnica colorimétrica para verificarlo empleando el método de las velocidades iniciales.
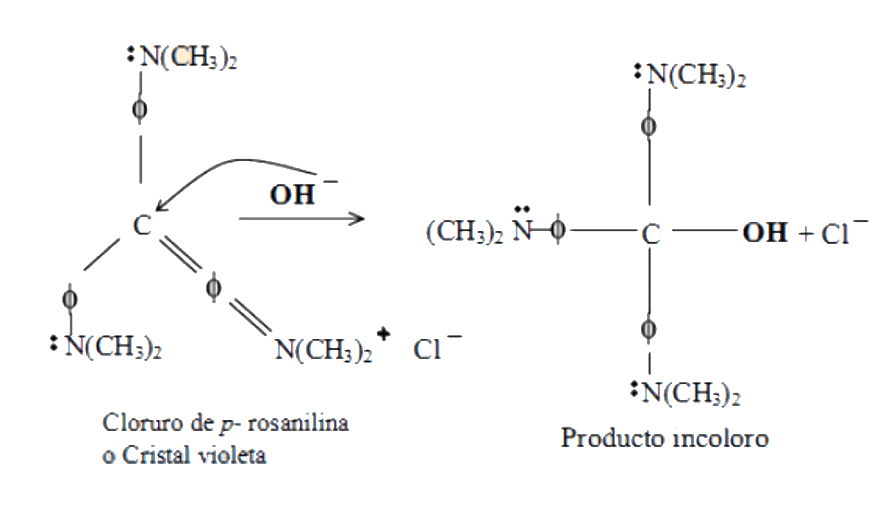
Un mecanismo de reacción explica cómo se forman los productos a partir de los reactivos, describe, paso por paso, el proceso de ruptura y formación de enlaces. La reacción entre el cristal violeta y el hidróxido de sodio puede ocurrir a través de un mecanismo SN1 o un mecanismo SN2.
El mecanismo SN1 que corresponde a una sustitución nucleofílica unimolecular. Ocurre a través de un intermediario catiónico, por lo que solamente se involucra un reactivo en el paso determinante y la reacción es de orden uno. La cinética de tal reacción solo dependerá de la concentración del sustrato que forma al carbocatión y no de la concentración del nucleófilo OH¯, la velocidad de reacción con respecto al nucleófilo sería cero.

El estado de transición es iónico y se ve estabilizado en medios polares, aumentando la velocidad de reacción, esto se logra agregando sales que aumenten la polaridad del medio. El mecanismo SN2 ocurre en un solo paso concertado, por lo que requiere de la participación de los dos reactivos involucrados en la sustitución nucleofílica y la reacción es de orden 2.
La cinética de tal reacción dependerá de la concentración tanto del sustrato como del nucleófilo OH¯. Un medio iónico eleva la energía del estado de transición y hay una disminución en la velocidad de reacción.
Cuando a una reacción de segundo orden se le agrega uno de los reactivos en exceso, este prácticamente permanecerá constante con respecto al otro y la cinética de la reacción será ahora de pseudoprimer orden.
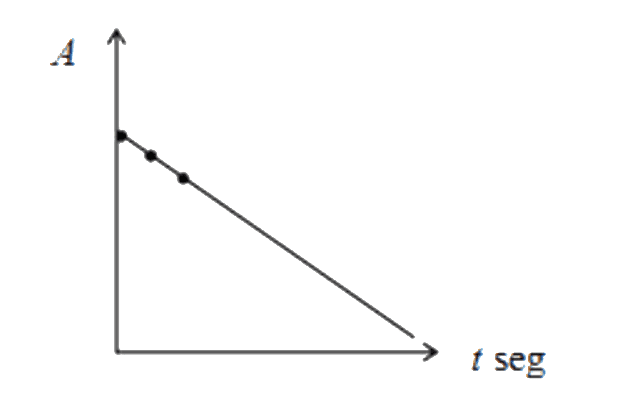
La reacción entre el cristal violeta y el hidróxido de sodio se seguirá a través de la disminución de la absorbancia del cristal violeta CV en la región del espectro visible con longitud de onda de 590 nm, en tres corridas manteniéndose constante en dos de ellas, la concentración del cristal violeta, y en otras dos la concentración de la base. Por último, se repetirán las tres corridas, pero ahora con un exceso de la base. La variación de 2 absorbancias A iniciales con el tiempo t (pendiente m), es directamente proporcional (α) a la velocidad inicial de la reacción r.
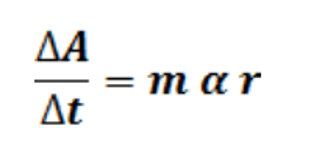
Las velocidades iniciales son proporcionales (α) a las concentraciones iniciales, medidas con la absorbancia, siendo la constante de proporcionalidad la constante de velocidad. Así el logaritmo natural de la relación de pendientes iniciales m0 con respecto al logaritmo natural de la relación de concentraciones iniciales C0 del reactivo que cambia en dos corridas, proporciona el valor del orden parcial de tal reactivo
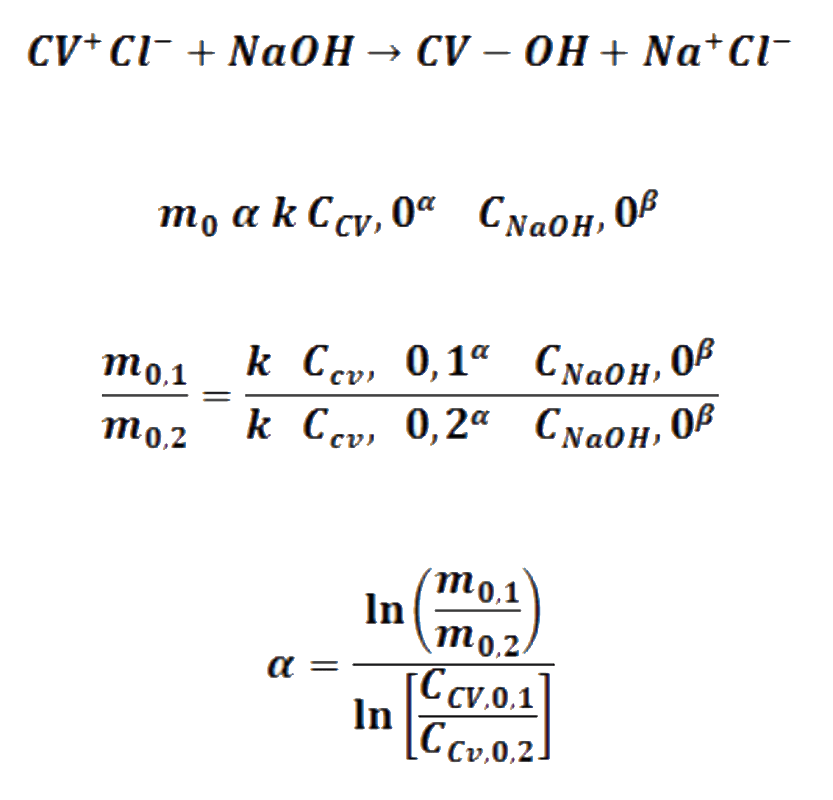
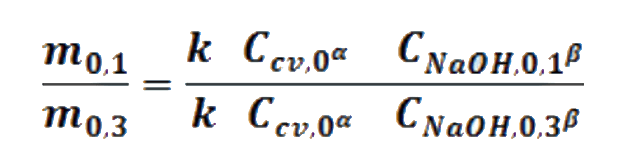
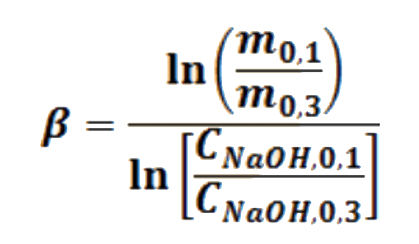
Materiales
- 2 pipetas graduadas de 5 mL
- Termómetro
- 2 pipetas Pasteur plásticas de 1 mL
- Vaso de precipitados de 100 mL
- Propipeta o pipeteador
- Espectrofotómetro con cubeta
- Papel de limpieza
Reactivos
- Soluciones:
- Cristal violeta 5*10-5 M (0.02 g/L)
- Hidróxido de sodio 0.02M
- Nitrato de potasio 1M
- Agua destilada
Procedimiento – Verificación de un mecanismo de reacción
Tiempo necesario: 2 horas
Verificación de un mecanismo de reacción
- Preparación y calibración del equipo
Seguir el procedimiento de calibración del equipo de espectrofotometría según las recomendaciones del fabricante del equipo y los procedimientos estándar del laboratorio.
Si el equipo lo permite, programar el espectrofotómetro para llevar a cabo la lectura en el espacio de 16 minutos y lecturas de absorbancia cada minuto o cada 30 segundos. Si el equipo no es programable, realizar este procedimiento manualmente.
La técnica consiste en: un blanco de reacción, un testigo de cristal violeta que será empleado para la medición de la cinética de reacción en los primeros 4 minutos y volúmenes de cristal violeta que serán empleados para la estimación de la cinética.Anuncio - Corrida 1
Según las especificaciones del espectrofotómetro y su operación, realizar la medición de las mezclas reactantes.
Insertar una celda de cuarzo con 2.5 mL de agua destilada, este será el blanco y una gota de hidróxido de sodio en el equipo y ajustar la medición
En una celda de cuarzo agregar 2.5 mL de solución de cristal violeta e introducirla para su medición, correr el programa y esperar 4 minutos de medición.
Preparar otra celda de cuarzo paralelamente 2.5 mL de solución de cristal violeta, y justo antes de intercambiarlo por el testigo una gota de hidróxido de sodio y agitar. Intercambiar por la celda de cuarzo con el testigo antes de los 4 minutos y dejar que el espectrofotómetro siga su corrida de medición.
AnuncioSalvar los datos de medición en un archivo interno del equipo o anotándolo manualmente.
- Corrida 2
El blanco es el mismo que el empleado en la corrida 1, solo que agregando otra gota de hidróxido de sodio. Ajustar la medición.
Introducir la misma celda testigo en el equipo e iniciar la medición.
Preparar otra celda con contenido del tubo reactor 2 y antes de realizar el cambio por el testigo agregar 2 gotas de hidróxido de sodio. Homogenizar e intercambiar por el testigo, permitir que el equipo termine su corrida de medición.
Anuncio- Corrida 3 – Efecto salino primario de Brönsted
Al contenido de la celda blanco agregar una gota de solución de nitrato de potasio. Introducir al equipo y ajustar la medición.
Al tubo testigo agregar 1 gota de solución de nitrato de potasio, homogenizar e iniciar la medición.
Paralelamente preparar una celda con 2.5 mL de cristal violeta y agregar justo antes del cambio de celda 2 gotas de hidróxido de sodio y una gota de solución de nitrato de potasio, homogenizar e intercambiar por el testigo. Dejar que el espectrofotómetro termine su corrida. Guardar los datos.
Estos datos probarán el efecto de sal primaria de Brönsted (aumenta el carácter iónico del medio y si hay formación de carbocatión este se estabilizará y favorecerá la reacción SN1 aumentando la “velocidad” con respecto a la de la corrida 1). O disminuyendo la velocidad (pendiente) si el proceso es SN2 con intermediario concertado.
Después del laboratorio
Con los datos obtenidos elaborar gráficas de absorbancia vs. tiempo, para cada corrida. Efectuar las gráficas en un programa como Microsoft Excel ®. En el mismo gráfico trazar las curvas de la corrida 1 y 3, si estas no coinciden, la reacción es de primer orden con respecto al hidróxido de sodio.
La corrida 3 corresponde a un experimento realizado en medio iónico. Si el complejo activado tuviera carga eléctrica (carbocatión, mecanismo de reacción SN1 ), la ionicidad del medio estabilizaría tanto al estado base iónico (cristal violeta), como al estado de transición, no se afectaría o sufriría un aumento en el valor de la pendiente m en la corrida 3 con respecto a la corrida 2, por otro lado si el complejo activado es neutro (mecanismo SN2 ), el medio iónico estabilizaría solo el estado base y no al complejo activado y la pendiente m de la corrida 3 sería menor que la de las corridas 2 (reacción más lenta)
De acuerdo con los valores de las pendientes cuales serían los órdenes parciales α y β, de la reacción entre el cristal violeta y el hidróxido de sodio. ¿Cuál es el orden global de la reacción? ¿es ésta una reacción SN1 o SN2?
Para más información Chemical Kinetics: Rate Law for Reaction of Crystal Violet
Como citar este artículo:
APA: (2020-07-08). Verificación de un mecanismo de reacción. Recuperado de https://quimicafacil.net/manual-de-laboratorio/verificacion-de-un-mecanismo-de-reaccion/
ACS: . Verificación de un mecanismo de reacción. https://quimicafacil.net/manual-de-laboratorio/verificacion-de-un-mecanismo-de-reaccion/. Fecha de consulta 2026-02-27.
IEEE: , "Verificación de un mecanismo de reacción," https://quimicafacil.net/manual-de-laboratorio/verificacion-de-un-mecanismo-de-reaccion/, fecha de consulta 2026-02-27.
Vancouver: . Verificación de un mecanismo de reacción. [Internet]. 2020-07-08 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/verificacion-de-un-mecanismo-de-reaccion/.
MLA: . "Verificación de un mecanismo de reacción." https://quimicafacil.net/manual-de-laboratorio/verificacion-de-un-mecanismo-de-reaccion/. 2020-07-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net