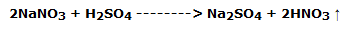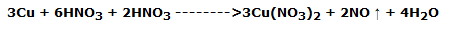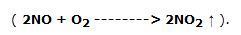Tiempo de lectura estimado: 4 minutos
El ácido nítrico (HNO3), también conocido como aqua fortis (agua fuerte en latín) y espíritu de nitro, es un ácido mineral muy corrosivo.
El compuesto puro es incoloro, pero las muestras más antiguas tienden a adquirir un tono amarillo debido a la descomposición en óxidos de nitrógeno y agua. La mayor parte del ácido nítrico comercializado tiene una concentración del 68% en agua. Cuando la solución contiene más del 86% de HNO3, se denomina ácido nítrico fumante. Dependiendo de la cantidad de dióxido de nitrógeno presente, el ácido nítrico fumante se caracteriza además como ácido nítrico fumante rojo en concentraciones superiores al 86%, o ácido nítrico fumante blanco en concentraciones superiores al 95%.
El ácido nítrico es el principal reactivo utilizado para la nitración, es decir, la adición de un grupo nitro, normalmente a una molécula orgánica. Mientras que algunos de los compuestos nitro resultantes son explosivos sensibles a los golpes y al calor, unos pocos son lo suficientemente estables como para ser utilizados en municiones y demoliciones, mientras que otros son aún más estables y se utilizan como pigmentos en tintas y tintes. El ácido nítrico también se utiliza habitualmente como agente oxidante fuerte.
Materiales
- Erlenmeyer de 200 mL
- Vaso de precipitados de 100 mL
- Pipeta graduada de 50 mL
- Propipeta o pipeteador
- Tapón con tubo de vidrio
- Tubo de goma
- Espátula
- Tubo de ensayo
Reactivos
- Nitrato de sodio, cristalino
- Ácido sulfúrico sol. 95 %
- Naranja de metilo sol. 0,02 %
- Lámina de cobre
- Carbonato de calcio
Procedimiento
Este es uno de los métodos clásicos de preparación en el laboratorio por reacción del ácido sulfúrico con el nitrato de sodio:
Se vierte agua destilada y unas gotas de solución de naranja de metilo en un vaso de precipitados de 100 mL; el color, dada su neutralidad, aparece amarillo-naranja. Este será el vaso de precipitados que se empleará para confirmar la producción del ácido.
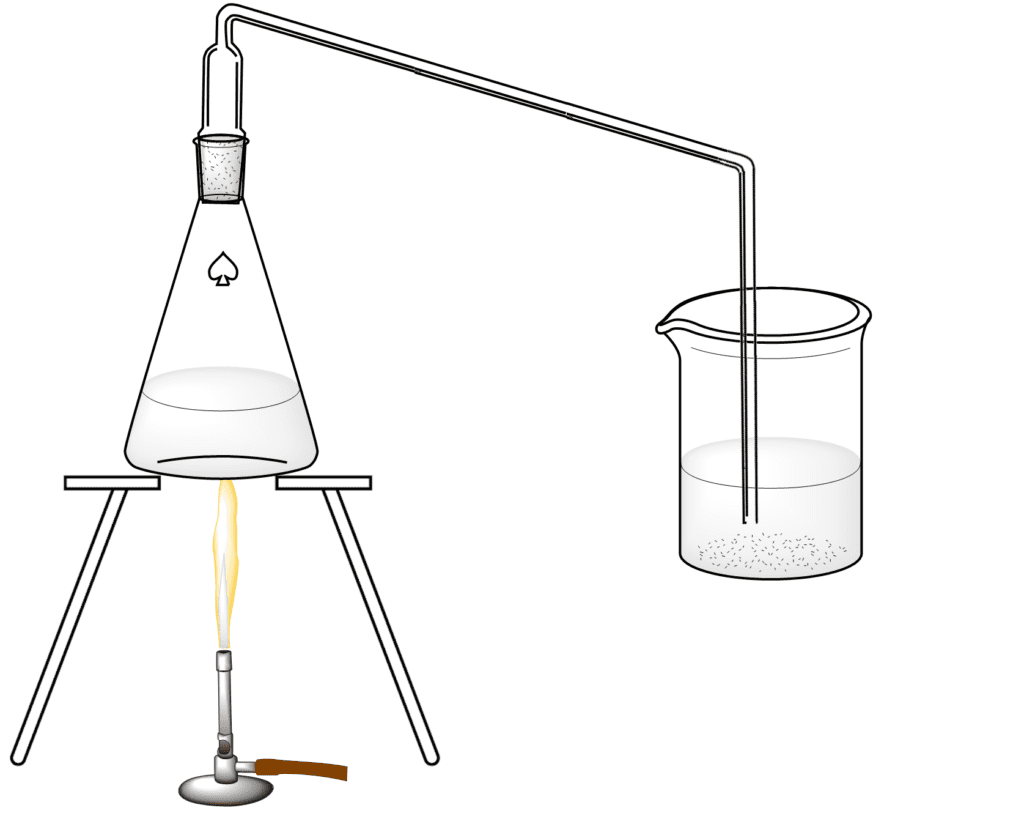
Colocar en un matraz Erlenmeyer de 200 ml unos 5 g de nitrato de sodio sobre los que, con una pipeta, se dejarán caer unos 10 mL de ácido sulfúrico, azufre 95 %; cerrar rápidamente con un tapón provisto de un tubo de desprendimiento.
Colocar el matraz en un trípode con una malla de amianto o malla de calentamiento de cerámica colocada sobre un mechero Bunsen y comenzar a calentar, con mucha precaución, hasta el punto de ebullición (también es posible realizar el montaje con una plancha de calentamiento).
Después de unos segundos se produce una reacción con el desarrollo de un gas que, burbujeando en el agua del vaso de precipitados, convierte el naranja de metilo en rojo, revelándose así como un ácido, el ácido nítrico (HNO3).
Si se desea, es posible, utilizando una mayor cantidad de reactivos, preparar una solución más concentrada de este ácido, que es muy soluble en agua. La solución así preparada puede ensayarse no sólo por su pH, sino también por su capacidad de reaccionar con el cobre.
Confirmación de la síntesis de acido nítrico por reacción
Tomar 5/10 mL de la solución, preparada por burbujeo, de ácido nítrico y viértelo en un tubo de ensayo; añade a él un pequeño trozo de lámina de cobre, que reacciona según la reacción conocida:
El óxido de nitrógeno reacciona con el oxígeno del aire para producir dióxido de nitrógeno, un gas de color marrón y olor penetrante:
La solución adquiere un color azul debido a la presencia de iones Cu2+.
Después del laboratorio
Según la reacción empleada en el laboratorio para la síntesis de ácido nítrico, hacer los cálculos estequiométricos para la obtención de 1 litro de solución 1M de este ácido asumiendo que todo el acido producido en la reacción se disuelve en el agua.
¿la técnica empleada en el laboratorio es adecuada para la producción de acido nítrico a escala industrial?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Nitric acid
Como citar este artículo:
APA: (2021-09-01). Síntesis de ácido nítrico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-nitrico/
ACS: . Síntesis de ácido nítrico. https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-nitrico/. Fecha de consulta 2026-02-27.
IEEE: , "Síntesis de ácido nítrico," https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-nitrico/, fecha de consulta 2026-02-27.
Vancouver: . Síntesis de ácido nítrico. [Internet]. 2021-09-01 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-nitrico/.
MLA: . "Síntesis de ácido nítrico." https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-nitrico/. 2021-09-01. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net