Actualizado en enero 9, 2024
Tiempo de lectura estimado: 6 minutos
El ácido perclórico es un ácido inorgánico con fórmula HClO4. Normalmente se encuentra en solución acuosa, este compuesto incoloro es un ácido más fuerte que el ácido sulfúrico y el ácido nítrico.

Es un oxidante poderoso cuando está caliente, pero las soluciones acuosas de hasta aproximadamente el 70% en peso a temperatura ambiente son generalmente seguras, sólo muestran características de ácido fuerte y no tienen propiedades oxidantes.
El ácido perclórico es útil para preparar sales de perclorato, especialmente el perclorato de amonio, un importante componente del combustible para cohetes. El ácido perclórico es peligrosamente corrosivo y forma fácilmente mezclas potencialmente explosivas.
Producción del ácido perclórico
Este ácido se produce industrialmente por dos vías. El método tradicional aprovecha la alta solubilidad acuosa del perclorato de sodio (209 g/100 mL de agua a temperatura ambiente). El tratamiento de estas soluciones con ácido clorhídrico da ácido perclórico, precipitando el cloruro de sodio sólido:

El ácido concentrado puede ser purificado por destilación. La ruta alternativa, que es más directa y evita las sales, implica la oxidación anódica del cloro acuoso en un electrodo de platino.
Síntesis en laboratorio
El tratamiento del perclorato de bario con ácido sulfúrico precipita el sulfato de bario, dejando el ácido perclórico.
También se puede hacer mezclando ácido nítrico con perclorato de amonio e hirviendo mientras se añade ácido clorhídrico. La reacción produce óxido nitroso y ácido perclórico debido a una reacción concurrente en la que participa el ion amonio y puede concentrarse y purificarse significativamente hirviendo los ácidos nítrico y clorhídrico restantes.
Propiedades
El ácido perclórico anhidro es un líquido aceitoso inestable a temperatura ambiente. Forma por lo menos cinco hidratos, varios de los cuales han sido caracterizados cristalográficamente. Estos sólidos consisten en el anión perclorato unido mediante enlaces de hidrógeno a los centros H2O y H3O+.
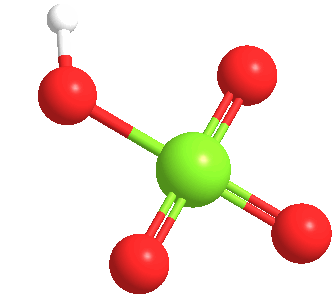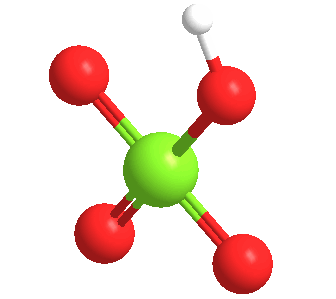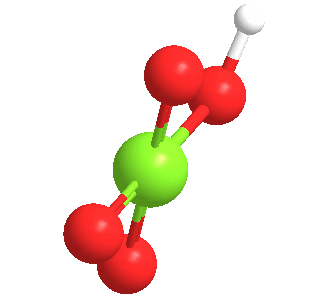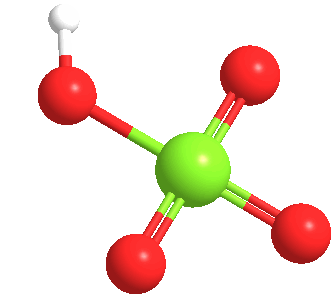
El ácido perclórico forma un azeotrópico con el agua, que consiste en aproximadamente un 72,5% de ácido. Esta forma de ácido es estable indefinidamente y está disponible comercialmente. Tales soluciones son higroscópicas. Así, si se deja abierto al aire, el ácido perclórico concentrado se diluye absorbiendo agua del aire.
La deshidratación del ácido perclórico da al anhídrido dicloro heptóxido:

Usos
El ácido perclórico se produce principalmente como precursor del perclorato de amonio, que se utiliza en el combustible para cohetes. El crecimiento de la cohetería ha llevado a un aumento de la producción de ácido perclórico.
Anualmente se producen varios millones de kilogramos. Este ácido es uno de los materiales más probados para el grabado de pantallas de cristal líquido y aplicaciones electrónicas críticas, así como para la extracción de minerales, y tiene propiedades únicas en la química analítica. Además, es un componente útil en el grabado de cromo.
El ácido perclórico como superácido
El ácido perclórico, un superácido, es uno de los ácidos Brønsted-Lowry más fuertes. El hecho de que su pKa sea inferior a -9 queda demostrado por el hecho de que su monohidrato contiene iones de hidronio discretos y puede aislarse como un sólido estable y cristalino, formulado como [H3O+][ClO4–].
La estimación más reciente de su pKa acuosa es de -15,2 ± 2,0. Proporciona una fuerte acidez con una interferencia mínima porque el perclorato es débilmente nucleófilo (lo que explica la alta acidez del HClO4). Otros ácidos de aniones no coordinados, como el ácido fluorobórico y el ácido hexafluorofosfórico son susceptibles de hidrólisis, mientras que el ácido perclórico no lo es.

A pesar de los peligros asociados a la explosividad de sus sales, el ácido es a menudo preferido en ciertas síntesis. Por razones similares, es un eluyente útil en la cromatografía de intercambio iónico.
También se utiliza para el electropulido o el grabado de aluminio, molibdeno y otros metales.
Riesgos
Dadas sus fuertes propiedades oxidantes, el ácido perclórico está sujeto a extensas reglamentaciones. Es altamente reactivo con los metales (por ejemplo, el aluminio) y la materia orgánica (madera, plásticos). Los trabajos realizados con ácido perclórico deben llevarse a cabo en campanas de gases con capacidad de lavado para evitar la acumulación de oxidantes en los conductos.
El 20 de febrero de 1947, en Los Ángeles, California, 17 personas murieron y 150 resultaron heridas al explotar una bañera, compuesta por más de 1000 litros de ácido perclórico al 75% y de anhídrido acético al 25% en volumen. La planta de electrodeposición de O’Connor, otros 25 edificios y 40 automóviles fueron destruidos y 250 casas cercanas sufrieron daños.
La bañera se estaba utilizando para electro-pulir los muebles de aluminio. Además, se añadieron compuestos orgánicos al baño de sobrecalentamiento cuando se sustituyó una rejilla de hierro por otra recubierta de acetobutirato de celulosa (plástico Tenit-2). Unos minutos más tarde la bañera explotó.

Para más información Perchloric acid | HClO4 – PubChem
Como citar este artículo:
APA: (2020-11-03). Ácido perclórico. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/acido-perclorico/
ACS: . Ácido perclórico. https://quimicafacil.net/compuesto-de-la-semana/acido-perclorico/. Fecha de consulta 2024-07-27.
IEEE: , "Ácido perclórico," https://quimicafacil.net/compuesto-de-la-semana/acido-perclorico/, fecha de consulta 2024-07-27.
Vancouver: . Ácido perclórico. [Internet]. 2020-11-03 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/acido-perclorico/.
MLA: . "Ácido perclórico." https://quimicafacil.net/compuesto-de-la-semana/acido-perclorico/. 2020-11-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net