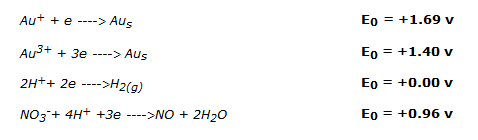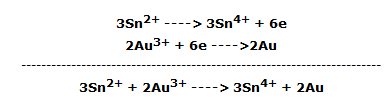Actualizado en febrero 15, 2022
Tiempo de lectura estimado: 4 minutos
El oro ha sido calificado como el más bello de todos los elementos químicos. Su belleza lo ha hecho deseable para su uso en joyas, monedas y obras de arte durante miles de años. Fue uno de los primeros metales puros que utilizó el ser humano.
El oro es uno de los pocos elementos que pueden afectar a la política y la economía. Se han librado guerras por el acceso al oro. Han surgido y desaparecido ciudades y pueblos a medida que se descubría y extraía el oro. Muchas naciones siguen contando su riqueza en función de la cantidad de oro que tienen almacenado.
El oro es un metal precioso extremadamente estable; no puede ser oxidado por los ácidos normales, como el clorhídrico o el nítrico, debido a su alto potencial electroquímico.
Dos estados de oxidación son posibles para el oro: Au3+, el más común, y Au+; en ambos casos los potenciales son mayores que los del ácido nítrico y el ácido clorhídrico:
La oxidación del oro puede tener lugar por la acción de una mezcla, en proporciones de 1:3 entre el mismo ácido nítrico concentrado y el ácido clorhídrico; la mezcla se llama agua regia.
En esta mezcla el ácido nítrico actúa como oxidante mientras que los iones Cl– del ácido clorhídrico forman con los iones Au3+ un complejo cloroaúrico [AuCl4]–. El complejo elimina los iones Au3+ de la solución y al mismo tiempo el ácido nítrico oxida otros iones del metal; esto, aunque el Keq de la reacción es desfavorable, conduce sin embargo a la solubilización completa del oro.
La reacción iónica que tiene lugar es:
La reducción del ion Au3+ es posible mediante el cloruro de estaño (II). De hecho, algunas gotas de solución de SnCl2 en una solución de cloruro áurico dan un precipitado de oro dicroico coloidal, marrón por reflexión y azul verdoso por transparencia, llamado púrpura de Cassius.
La reacción redox es:
Materiales
- Vaso de precipitado de 100 mL
- 2 pipetas graduadas de 50 mL
- Pipeta graduada de 10 mL
- Propipetas o pipeteadores
- Probeta de 100 mL
- Tubos de ensayo
- Gradilla
Reactivos
- Oro metálico
- Ácido nítrico sol. 65 %
- Ácido clorhídrico sol. 37 %
- Cloruro de estaño (II)
Procedimiento
Primera parte: oxidación del oro con agua regia:
Se prepara una cantidad mínima de agua regia vertiendo en un vaso de precipitados de 100 mL 30 mL de sol de ácido clorhídrico. 37 %; a esto se añaden, con una pipeta, lenta y cuidadosamente, 10 mL de ácido nítrico sol. 65 %. Mezclar con una varilla de vidrio y dejar reposar unos minutos.
Coloque la muestra de oro en un tubo de ensayo, posiblemente también de oro comercial 750 ‰, y vierta en él una cantidad suficiente de agua regia; espere hasta que el oro esté completamente solubilizado.
La solución resultante, de color ligeramente amarillo, es una solución fuertemente ácida de [AuCl4]– esta solución puede utilizarse para el siguiente paso.
Segunda parte: reducción de Au3+ a oro por cloruro de estaño (II):
Prepara un tubo de ensayo que contenga 4 ó 5 mL de agua destilada; en él vierte con una pipeta aproximadamente 1 mL de la solución ácida de [AuCl4]– y la cantidad de una punta de espátula de cloruro de estaño (II) (SnCl2); agitar y en poco tiempo puedes observar la formación de oro coloidal (púrpura de Cassius) con aspecto dicroico, marrón a la reflexión y azul verdoso por transparencia.
En caso de que la cantidad de ion cloroaúrico sea muy alta se observá una coloración negruzca, por lo que será necesario repetir el experimento con una menor cantidad de reactivo.
Nota operativa: el agua regia es bastante inestable, por lo que es necesario prepararla en el momento del experimento en pequeñas cantidades.
La cantidad de oro necesaria es muy pequeña; se puede utilizar un eslabón de cadena roto, no muy grande, para producir unos 10 mL de solución cloroaúrica.
Para más información Purple of Cassius Preparation
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-03-17). Oxidación y reducción del oro. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-inorganica/oxidacion-y-reduccion-del-oro/
ACS: . Oxidación y reducción del oro. https://quimicafacil.net/manual-de-laboratorio/q-inorganica/oxidacion-y-reduccion-del-oro/. Fecha de consulta 2024-07-27.
IEEE: , "Oxidación y reducción del oro," https://quimicafacil.net/manual-de-laboratorio/q-inorganica/oxidacion-y-reduccion-del-oro/, fecha de consulta 2024-07-27.
Vancouver: . Oxidación y reducción del oro. [Internet]. 2021-03-17 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-inorganica/oxidacion-y-reduccion-del-oro/.
MLA: . "Oxidación y reducción del oro." https://quimicafacil.net/manual-de-laboratorio/q-inorganica/oxidacion-y-reduccion-del-oro/. 2021-03-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net