Actualizado en septiembre 15, 2021
Tiempo de lectura estimado: 4 minutos
Uno de los métodos para proteger de la corrosión a los metales es depositar en su superficie otros metales más resistentes al ambiente corrosivo.
Estos metales pueden depositarse directamente a partir del estado fundido (como es el caso del galvanizado) o mediante el empleo de una celda electrolítica adecuada. En este caso el material que se desea proteger actúa como cátodo y el metal a depositar se puede encontrar en la solución electrolítica y también formando parte del ánodo.
Corrosión
Los metales que se depositan no solo actúan como barreras protectoras, sino que adicionalmente pueden conferir dureza (el caso del cromo) o una presentación brillante (cromo, níquel, etc.). Esto se consigue depositando distintas capas de metales dependiendo el propósito del cubrimiento.
Una definición de la corrosión es el deterioro que sufre un material a consecuencia de un ataque químico por su entorno. Siempre que la corrosión esté originada por reacción química, la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura y de la concentración de los reactivos y de los productos. Otros factores, como el esfuerzo mecánico y la erosión también pueden contribuir al deterioro.
La mayor parte de la corrosión de los materiales concierne al ataque químico de los metales, el cual ocurre principalmente por ataque electroquímico, ya que los metales tienen electrones libres que son capaces de establecer pilas electroquímicas dentro de los mismos.
Corrosión en reacciones electroquímicas
Las reacciones electroquímicas exigen un electrolito conductor, cuyo soporte es habitualmente el agua. De aquí que en ocasiones se le denomine «corrosión acuosa». Muchos metales sufren corrosión en mayor o menor grado por el agua y la atmósfera. Los metales también pueden ser corroídos por ataque químico directo procedente de soluciones químicas. Otro tipo de degradación de los metales que sucede por reacción química con el medio, fenómeno conocido como «corrosión seca», que constituye en ocasiones una degradación importante de los metales especialmente cuando va acompañado de altas temperaturas.
Materiales no metálicos como las cerámicas y los polímeros no sufren el ataque electroquímico, pero pueden ser deteriorados por ataques químicos directos. Por ejemplo, los materiales cerámicos refractarios pueden ser atacados químicamente a altas temperaturas por las sales fundidas. Los polímeros orgánicos pueden ser deteriorados por el ataque químico de solventes orgánicos. El agua es absorbida por algunos polímeros orgánicos, provocando en ellos cambios dimensionales o en sus propiedades. La acción combinada de oxígeno y radiación ultravioleta es susceptible de destruir algunos polímeros, incluso a temperatura ambiente.
Materiales
- 1 vaso de precipitados de 250 mL
- 2 vasos de precipitados de 100 mL
- Electrodos de cobre
- Tubo en U de vidrio
- Plancha de calentamiento
- Plancha de agitación
- Voltímetro o multímetro
- Termómetro
Reactivos
- Solución de cloruro de sodio 3.5%
- Agua destilada
Procedimiento
Tiempo necesario: 45 minutos
Corrosión por Temperatura Diferencial
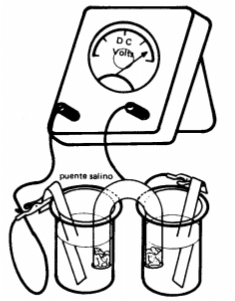
Realizar el montaje que se observa a continuación. El tubo en U esta lleno de la solución de cloruro de sodio y sellado por cada extremo con algodón empapado en solución salina.
 Anuncio
AnuncioColocar uno de los vasos de precipitados en la plancha de calentamiento y el otro en la plancha de agitación para que queden a la misma altura (o se pueden emplear dos planchas de calentamiento iguales para este fin)
Iniciar el calentamiento de uno de los vasos de precipitados
cuando la solución este a punto de hervir, detener el calentamiento y conectar el voltímetro o multímetro para medir el signo y la magnitud de la diferencia de potencial entre ambos electrodos.
Registrar la diferencia de potencial a lo largo del tiempo registrando tiempo, temperatura y voltaje.
Anuncio
Después del experimento
Con base al valor obtenido por el voltímetro y teniendo en cuenta las leyes de Faraday, ¿Cuál de los electrodos es el reductor?
Escribir la semirreacción que tiene lugar en el electrodo en la solución caliente.
Graficar el voltaje obtenido vs la temperatura leída en el termómetro, identificar el comportamiento observado. Explicar a la luz de la fisicoquímica este fenómeno.
Recomendaciones de seguridad
Se debe leer el manual de operación del voltímetro o multímetro a emplear, o recibir instrucción sobre su correcto manejo por parte de personal experto.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2019-10-02). Corrosión por Temperatura Diferencial. Recuperado de https://quimicafacil.net/manual-de-laboratorio/temp-diferencial/
ACS: . Corrosión por Temperatura Diferencial. https://quimicafacil.net/manual-de-laboratorio/temp-diferencial/. Fecha de consulta 2024-07-27.
IEEE: , "Corrosión por Temperatura Diferencial," https://quimicafacil.net/manual-de-laboratorio/temp-diferencial/, fecha de consulta 2024-07-27.
Vancouver: . Corrosión por Temperatura Diferencial. [Internet]. 2019-10-02 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/temp-diferencial/.
MLA: . "Corrosión por Temperatura Diferencial." https://quimicafacil.net/manual-de-laboratorio/temp-diferencial/. 2019-10-02. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net