Tiempo de lectura estimado: 7 minutos
Las proteínas son de especial interés en la bioquímica debido a sus múltiples roles y propiedades que exhiben en los sistemas biológicos. Las estructuras de las proteínas son muy diversas debido a la casi infinita posibilidad de combinaciones de aminoácidos que a su vez genera una gran cantidad de posibles combinaciones para las estructuras secundarias, terciarias y cuaternarias de las proteínas.
Existen una gran cantidad de métodos de clasificación de proteínas según criterios muy variados, que dependen de las propiedades de las proteínas, así como a su utilidad o interés. Una de las clasificaciones que se emplean en análisis de proteínas es la clasificación Osborne, que se basa en la solubilidad de una proteína en una solución determinada, de interés especial en el análisis de proteína proveniente de cereales.
Método de Biuret
Las proteínas pueden categorizarse de acuerdo con varios criterios. En el análisis de alimentos los criterios de clasificación más comunes son: fuente de la proteína, solubilidad, rol fisiológico y estructura secundaria.
Thomas Burr Osborne, bioquímico americano, en medio de sus investigaciones sobre la estructura, propiedades y funciones de las proteínas en cereales, desarrollo una clasificación de las proteínas con base a su solubilidad en una serie de solventes.
La extracción secuencial de las proteínas empleando agua, solución salina diluida, alcohol al 70% y solución básica diluida, genera cinco clases de proteínas: albumina, que es la proteína soluble en agua, globulina, que corresponden a las proteínas solubles en solución salina diluida, prolamina, soluble en etanol/agua, y glutelina, que se disuelve en soluciones básicas diluidas. Finalmente, después de las extracciones, se obtiene un residuo totalmente insoluble.
La separación de las fracciones en ocasiones es exacta, pero algunas globulinas pueden ser extraídas al mismo tiempo con albuminas y así sucesivamente. La clasificación de Osborne ha sufrido diversas modificaciones en los años sucesivos.
A pesar de que existen técnicas más avanzadas para el estudio y clasificación de proteínas, la clasificación de Osborne se sigue empleando en especial en el estudio de cereales y de proteínas de origen vegetal.
Materiales
- 16 tubos de ensayo
- Gradilla
- 1 beaker de 500 mL
- microespatula
- 1 pipeta aforada de 0.5 mL
- 5 pipetas aforadas de 0.1 mL
- 5 pipeta aforada de 10 mL
- 5 balones aforados de 25 mL
- 2 balones aforados de 5 mL
- 1 probeta de 100 mL
- 5 vidrios de reloj
- Micropipeta y puntas desechables
Reactivos
- Reactivo de Follin
- Solución de sulfato de cobre – tartrato de sodio y potasio*
- Solución de carbonato de sodio en hidróxido de sodio 0.1 M
- Solución de cloruro de sodio al 1%
- Etanol al 75%
- Hidróxido de sodio 0.1 M
- Agua desionizada
- Reactivo de Biuret
- Solución patrón de albumina de huevo (0.25 mg/mL)
- Espectrofotómetro
- Cubetas para espectrofotómetro
- Centrifuga
- Muestras de harina de diferentes cereales y leguminosas
* La solución de sulfato de cobre se prepara con una solución de sulfato de cobre pentahidratado de 5g/L y 10 g de tartrato de sodio y potasio por litro.
Procedimiento – Fraccionamiento de proteínas
Fracción de albuminas
Pesar 2 g de muestra de alguna de harina a disposición y llevarla a un tubo de ensayo. Agregar 10 mL de agua desionizada. Agitar por espacio de 10 minutos y centrifugar la suspensión a 2500 rpm por espacio de 3 minutos. Transferir con cuidado el sobrenadante a un balón aforado de 25 mL.
Repetir el lavado con 10 mL mas de agua desionizada y se transfiere nuevamente el sobrenadante al balón aforado de 25 mL. Aforar a 25 mL con agua. Esta solución corresponde a la fracción de albuminas. Marcar el balón.
Fracción de globulinas
En el tubo de ensayo con la muestra extraída de la harina de estudio, agregar 10 mL de solución de cloruro de sodio al 1%, agitar por 10 minutos y centrifugar la suspensión a 2500 rpm por 3 minutos. Transferir el sobrenadante a un balón aforado de 25 mL.
Repetir el procedimiento con otros 10 mL de solución salina y transferir el sobrenadante al balón aforado. Completar el volumen del balón y marcar.
Fracción de prolaminas
Tomando el residuo de las extracciones anteriores, se agregan 10 mL de alcohol etílico, se agita por 10 minutos y se coloca el tubo a baño de María a 60°C por 3 minutos, centrifugar la suspensión por 3 minutos a 2500 rpm. Transferir el sobrenadante a un balón aforado de 25 mL y repetir el proceso con 10 mL de etanol más. Llevar a volumen el balón con etanol y marcar.
Fracción de glutelinas
Tomar el residuo solido restante de la extracción de prolaminas y agregar 10 mL de solución de hidróxido de sodio 0.1 M, agitar por 10 minutos y centrifugar a 2500 rpm por 3 minutos. Transferir el sobrenadante a un balón aforado de 25 mL. Repetir el procedimiento y aforar el balón. Marcar.
Método de Biuret para cuantificación de proteínas
Se empleará el método de Biuret para cuantificar la cantidad de proteínas en cada una de las fracciones obtenidas anteriormente.
Preparación de solución patrón
Es necesario realizar una curva de calibración con una solución de albumina de huevo de concentración conocida para correlacionar la absorbancia medida con una concentración. En un tubo de ensayo limpio y seco se colocan 100 mg de albumina de huevo y 5 mL de agua desionizada, se agita y se transfiera de manera cuantitativa a un balón aforado de 10 mL. Completar a volumen con agua desionizada.
Adecuación de fracciones de proteínas a analizar
Para las fracciones de albuminas y glutelinas es necesario realizar una dilución 1:10. De la fracción de albuminas, tomar una alícuota de 0.5 mL y llevarla a un balón aforado de 5 mL, completar el volumen con agua desionizada.
Igualmente, tomar una alícuota de 0.5 mL de la fracción de glutelinas y llevarla a un balón aforado de 5 mL, aforar con solución de hidróxido de sodio 0.1 M.
Preparación de muestras para lectura
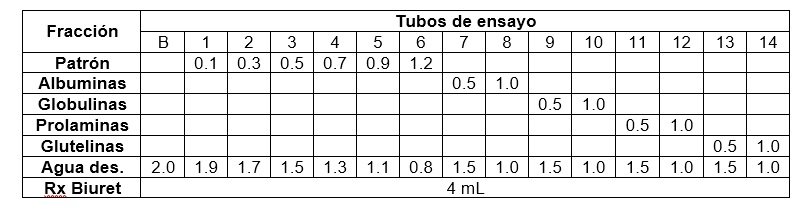
Tomar 15 tubos de ensayo limpios y secos, marcarlos con números del 1 – 14 y el ultimo es el blanco (B).
Con ayuda de una micropipeta o pipeta aforada de 0.1 mL, completar los volúmenes según la siguiente tabla (expresados en mL):
Mezclar bien y dejar en reposo por 30 minutos a temperatura ambiente. Para acelerar la reacción, se pueden colocar los tubos en un baño de María a 30°C por 10 minutos. Al finalizar el tiempo, se debe observar un desarrollo de color.
Ajustar el espectrofotómetro para leer absorbancia a una longitud de onda de 540 nm. Seguir el procedimiento estándar del equipo para ajustar el blanco empleando agua desionizada. Anotar los valores obtenidos.
Después del experimento
Con los valores de absorbancia obtenidos de las soluciones patrón, trazar un gráfico en un programa de hoja de calculo como Microsoft Excel ®, colocando en el eje x la absorbancia y en el eje y, la concentración. Realizar una regresión lineal para obtener la ecuación de la recta.
Con ayuda de la recta obtenida a partir de la curva patrón, calcular la cantidad de proteína presentes en cada una de las fracciones obtenidas, comparar los valores obtenidos con los reportados en la literatura para la fuente de proteína escogida para la práctica.
Investigar las principales características de cada una de las fracciones de proteínas obtenidas y el porque son solubles en las soluciones utilizadas.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Biuret Protein Assay
Como citar este artículo:
APA: (2019-03-27). Fraccionamiento de proteínas por solubilidad – Método de Biuret para cuantificación de proteínas. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fraccionamiento-de-proteinas-por-solubilidad-metodo-de-biuret-para-cuantificacion-de-proteinas/
ACS: . Fraccionamiento de proteínas por solubilidad – Método de Biuret para cuantificación de proteínas. https://quimicafacil.net/manual-de-laboratorio/fraccionamiento-de-proteinas-por-solubilidad-metodo-de-biuret-para-cuantificacion-de-proteinas/. Fecha de consulta 2025-07-05.
IEEE: , "Fraccionamiento de proteínas por solubilidad – Método de Biuret para cuantificación de proteínas," https://quimicafacil.net/manual-de-laboratorio/fraccionamiento-de-proteinas-por-solubilidad-metodo-de-biuret-para-cuantificacion-de-proteinas/, fecha de consulta 2025-07-05.
Vancouver: . Fraccionamiento de proteínas por solubilidad – Método de Biuret para cuantificación de proteínas. [Internet]. 2019-03-27 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fraccionamiento-de-proteinas-por-solubilidad-metodo-de-biuret-para-cuantificacion-de-proteinas/.
MLA: . "Fraccionamiento de proteínas por solubilidad – Método de Biuret para cuantificación de proteínas." https://quimicafacil.net/manual-de-laboratorio/fraccionamiento-de-proteinas-por-solubilidad-metodo-de-biuret-para-cuantificacion-de-proteinas/. 2019-03-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net