Estimated reading time: 6 minutos
Los esteres son grupos funcionales derivados de un ácido orgánico (aunque también puede ser inorgánico) en el cual al menos un grupo hidroxilo ha sido reemplazado por un alcohol.
Los esteres pueden ser encontrados en la naturaleza en los lípidos, en feromonas, compuestos con capacidad odorante, aceites esenciales entre otros. A nivel industrial son de suma importancia como solventes, ingredientes para la industria cosmética y de alimentos, plastificantes y como materia prima para síntesis de otros compuestos.
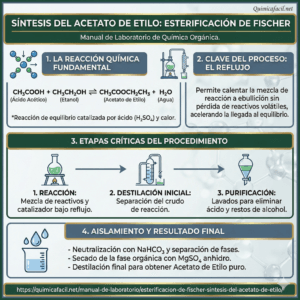
La esterificación de Fischer es uno de los métodos clásicos de obtención de esteres y una de las reacciones mas estudiadas debido a sus características de equilibrio, necesidad de la presencia de un catalizador y fácil montaje.
¿Que es la esterificación de Fischer?
La esterificación de Fischer consiste en tratar un ácido carboxílico con un alcohol en medio ácido que actúa como agente deshidratante. Esta reacción puede ser llevada a cabo sin la presencia de un ácido fuerte como catalizador, pero sucede de manera muy lenta. Generalmente se emplea ácido sulfúrico como catalizador de la reacción.
Otra de las características de esta reacción es el equilibrio que presenta entre sus productos y reactivos, que se emplea a menudo como modelo para el estudio del principio de Le Chatelier.

Para estimular la producción de ester se pueden emplear alguna alternativa para desplazar el equilibrio hacia el lado derecho de la reacción; se puede emplear un exceso de alcohol, un agente deshidratante como lo pueden ser los tamices moleculares o el mismo ácido sulfúrico, que no solo cataliza la reacción sino también secuestra moléculas de agua.
Otra de las alternativas para mejorar el desempeño de la reacción de esterificación es la remoción del agua producida en la reacción a través de destilación empleando azeótropos de baja temperatura como el obtenido con tolueno y un montaje Dean-Stark.
En esta práctica se emplearán como reactivos ácido acético, etanol en exceso y ácido sulfúrico como catalizador. El acetato de etilo se recuperará empleando destilación fraccionada.
Materiales
- Balón de fondo plano de 250 mL
- Pipeta de 10 mL
- Agitador de vidrio
- Condensador recto o de Liebig
- Condensador de bolas o de Allihn
- Termómetro
- Columna de fraccionamiento
- Adaptador de termómetro para destilación en 75°
- Soporte universal
- Pinzas con nuez
- 2 Erlenmeyer de 50 mL
- Vidrio de reloj
- Picnómetro de 5 mL
- Vasos de precipitado de 100 y 250 mL
- Balanza analítica
- Embudo de decantación de 100 mL
- Perlas de ebullición.
Reactivos
- Ácido acético glacial
- Ácido sulfúrico concentrado
- Solución de carbonato de calcio al 5%
- Sulfato de sodio anhidro
- Etanol
Procedimiento – esterificación de Fischer
Tiempo necesario: 50 minutos
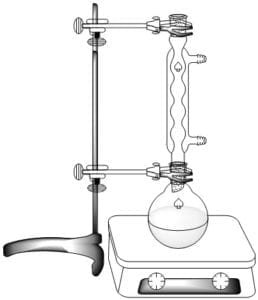
En un balón de fondo plano de 250 mL, adicionar 30 g de ácido acético glacial y 50 mL de etanol. Cuidadosamente, añadir 5 mL de ácido sulfúrico concentrado agitando continuamente.
Agregar unos trocitos de porcelana o esferas de vidrio y realizar el montaje de reflujo como se muestra en la figura. Dejar en reflujo por 30 minutos.
 Anuncio
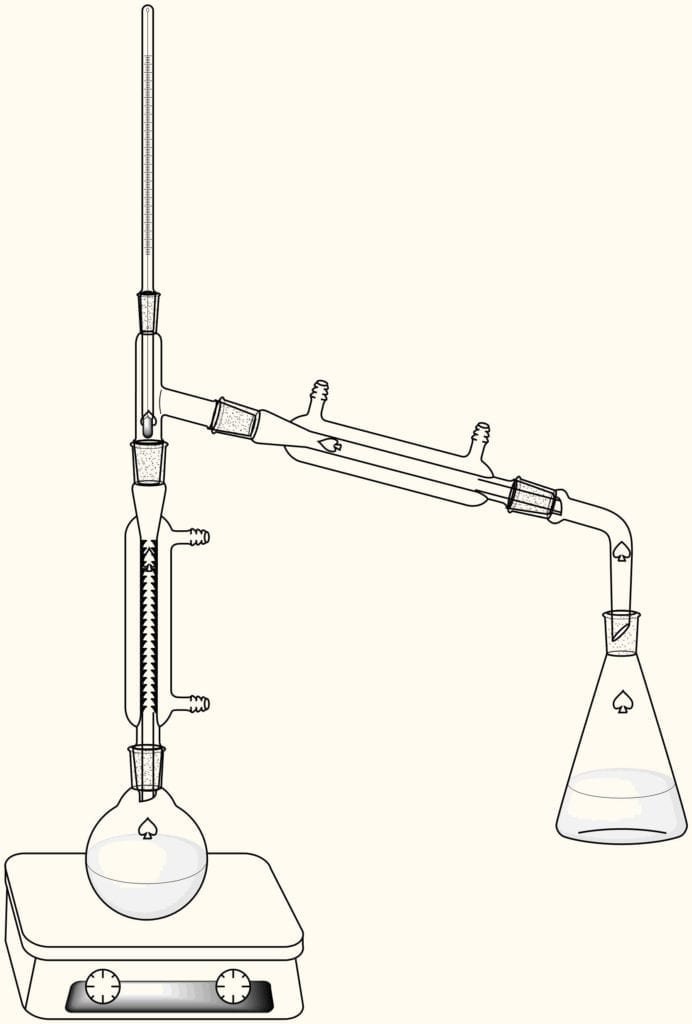
AnuncioTranscurrido el tiempo, dejar enfriar el equipo, desmontarlo y realizar un montaje para destilación fraccionada como el mostrado en la figura. Iniciar la destilación registrando el tiempo y la temperatura de los vapores de destilación.

La cabeza del destilado se recoge desde el inicio de la aparición de este hasta cerca de los 70°C, almacenar. El cuerpo del destilado se recoge entre 70 y 90°C, cuando se alcance dicha temperatura se puede suspender el calentamiento.
Tomar el cuerpo de la destilación y colocarlo en el embudo de separación de 100 mL, lavar con 50 mL de solución de carbonato de sodio al 5% para eliminar restos de etanol, ácido acético y ácido sulfúrico provenientes de la reacción. En este lavado puede liberarse dióxido de carbono, por lo que no se debe mantener cerrado el embudo de decantación por espacios prolongados de tiempo sino retirar parcialmente la tapa de vez en cuando. Dejar decantar las dos fases y drenar la capa inferior (acuosa).
Recuperar la fase orgánica en un Erlenmeyer y adicionar 10 g de sulfato de sodio anhidro. Deje secar por treinta minutos y separar el liquido del solido cuidadosamente. Si se desea obtener un producto mas puro, se puede redistilar el ester a partir de la fase orgánica sin separar el sulfato de sodio, obteniéndose el producto alrededor de los 75 – 77 °C.
AnuncioPesar la cantidad obtenida de acetato de etilo. No olvidar registrar todos los pesos y volúmenes de los reactivos y del producto obtenido.
Después del experimento
Tomando en cuenta las cantidades de reactivos empleados, calcular la masa teórica que se debe obtener de acetato de etilo producido. Comparar con la masa obtenida y hacer el calculo del rendimiento global del proceso.
Discutir sobre los factores que afectaron el rendimiento de la reacción de esterificación. Anotar y discutir las propiedades observadas del producto obtenido.
¿Que técnicas y propiedades se pueden emplear para la identificación del producto obtenido como acetato de etilo?
Recomendaciones de seguridad
Se debe tener cuidado en los procesos de destilación y reflujo, asegurando que siempre este circulando agua por los refrigerantes mientras se este suministrando calor al sistema. No olvidar agregar perlas de ebullición al sistema para evitar movimientos violentos cuando los productos y reactivos están en ebullición.
Tener precaución con el manejo del instrumental de vidrio caliente (El vidrio caliente luce exactamente igual que el vidrio frio).
No aspirar directamente los vapores liberados tanto en la reacción como en la purificación. Percibir el olor del acetato de etilo acercando un poco de los vapores a la nariz con ayuda de la mano.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Como citar este artículo:
APA: (2019-02-27). Esterificación de Fischer – Síntesis del acetato de etilo. Recuperado de https://quimicafacil.net/manual-de-laboratorio/esterificacion-de-fischer-sintesis-del-acetato-de-etilo/
ACS: . Esterificación de Fischer – Síntesis del acetato de etilo. https://quimicafacil.net/manual-de-laboratorio/esterificacion-de-fischer-sintesis-del-acetato-de-etilo/. Fecha de consulta 2026-02-17.
IEEE: , "Esterificación de Fischer – Síntesis del acetato de etilo," https://quimicafacil.net/manual-de-laboratorio/esterificacion-de-fischer-sintesis-del-acetato-de-etilo/, fecha de consulta 2026-02-17.
Vancouver: . Esterificación de Fischer – Síntesis del acetato de etilo. [Internet]. 2019-02-27 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/esterificacion-de-fischer-sintesis-del-acetato-de-etilo/.
MLA: . "Esterificación de Fischer – Síntesis del acetato de etilo." https://quimicafacil.net/manual-de-laboratorio/esterificacion-de-fischer-sintesis-del-acetato-de-etilo/. 2019-02-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net