Tiempo de lectura estimado: 5 minutos
Es común que en demostraciones donde los cambios químicos que acompañan cambios drásticos de color sirven para fortalecer el entusiasmo y el interés de los estudiantes en el estudio de la química.
Varios sistemas de reacción que presentan tales cambios de color han sido continuamente investigados para desarrollar materiales de enseñanza cada vez más efectivos y llamativos para los estudiantes y para el público en general.
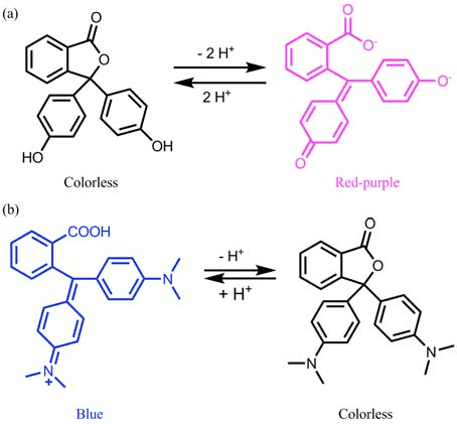
El equilibrio de disociación de protones de la fenolftaleína, como se muestra en la Imagen 1a, indica el cambio de color entre incoloro y rojo-morado por el cambio de equilibrio, es uno de los fenómenos de cambio de color más populares para los estudiantes de secundaria, debido a su utilización como un indicador ácido-base para la valoración de neutralización, elaboración de la fuente de amoníaco, entre otros.
La cristal violeta lactona es un análogo de la fenolftaleína que puede hacer el cambio de color cambiando el pH de la condición básica a la condición ácida (Imagen 1b). Estos cambios de color también se aplican a varias necesidades diarias como tintas invisibles, adhesivos transparentes y papeles térmicos.
Materiales
- 3 beaker de 50 mL
- 5 pipetas graduadas de 10 mL
- 3 pipetas Pasteur
- Varilla de agitación
- Pincel
- 2 atomizadores para líquidos
- 2 vasos de precipitados de 100 mL
- Propipeta o pipeteador
Reactivos
- Fenolftaleína
- cristal violeta lactona
- Solución de alcohol polivinílico al 10%
- Etanol
- ciclohexano
- Solución de hidróxido de sodio 2M
- Solución de ácido clorhídrico 2M
- Trietilamina
- Almidón
- Gelatina sin sabor
Demostraciones
Demostración 1: Tinta invisible.
- La solución colorante para la demostración se prepara mezclando 10 mg de fenolftaleína, 1 mL de solución acuosa de alcohol polivinílico al 10% y 1 mL de etanol.
- La solución básica de hidróxido de sodio se emplea como revelador de color, que se prepara agregando 1 mL de solución de NaOH 2M a 1 mL de solución acuosa de alcohol polivinílico al 10%.
- Por otro lado, la solución ácida que se utiliza como reactivo de blanqueo, se prepara adicionando 1 mL de solución de ácido clorhídrico 2M a 1 mL de solución acuosa de alcohol polivinílico al 10%.
- La solución colorante se aplica sobre un papel con un pincel, bien sea trazando un mensaje o un dibujo. Para revelar el mensaje o dibujo se aplica con el atomizador solución básica, observándose el desarrollo de un color rojo vivo sobre las líneas trazadas. Para volver a ocultar el mensaje, aplicar la solución acida con ayuda de un atomizador.
Demostración 2: Adhesivo desvaneciente.
El adhesivo de color azul se prepara mezclando 10 mg de 2,2′-dimetoxifenolftaleína (análogo de la fenolftaleína que se puede preparar cambiando el fenol en la síntesis de fenolftaleína por 2, 6 dimetilfenol), 1 g de pasta de almidón, 1 mL de solución acuosa de alcohol polivinílico al 10%, 1 gota de trietilamina y 1 mL de etanol.*
El adhesivo azul preparado se aplica sobre un papel con un pincel, y se comprueba el desvanecimiento del color con el paso del tiempo a simple vista.
*también se puede emplear fenolftaleína o cualquiera de sus análogos
Demostración 3: Papel térmico
Las partículas de gel que contienen cristal violeta lactona se preparan de la siguiente manera: Se disolvieron 0.5 g de gelatina en 2 mL de etanol acuoso al 50%, posteriormente en el cual se agrega 10 mg de cristal violeta lactona, agitando constantemente, preferiblemente con un agitador magnético o agitador mecánico.
Después de agitar a temperatura ambiente durante 1 hora, la mezcla se almacena en el refrigerador. El gel se suspende en 10 mL de ciclohexano con agitación vigorosa para formar partículas de gel, las cuales se dejan reposar hasta que se precipitan.
El sobrenadante se elimina por decantación y las partículas de gel se lavan dos veces con etanol. Las partículas de gel obtenidas se esparcen sobre un papel rociado previamente con solución acida con un cepillo para preparar un papel recubierto con gel. La coloración de este papel con tratamiento térmico se comprueba a simple vista al colocar una fuente de calor moderado cerca.
Después del experimento
Explicar desde el punto de vista químico y fisicoquímico cada uno de los efectos observados en las demostraciones.
¿Se podrían emplear otros indicadores en la realización de las demostraciones?, si es así, ¿Qué ajustes son necesarios para realizar las demostraciones?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Phenolphthalein as Organic Teaching Materials
Como citar este artículo:
APA: (2020-05-13). Demostraciones con fenolftaleína y análogos. Recuperado de https://quimicafacil.net/manual-de-laboratorio/demostraciones-con-fenolftaleina-y-analogos/
ACS: . Demostraciones con fenolftaleína y análogos. https://quimicafacil.net/manual-de-laboratorio/demostraciones-con-fenolftaleina-y-analogos/. Fecha de consulta 2026-02-20.
IEEE: , "Demostraciones con fenolftaleína y análogos," https://quimicafacil.net/manual-de-laboratorio/demostraciones-con-fenolftaleina-y-analogos/, fecha de consulta 2026-02-20.
Vancouver: . Demostraciones con fenolftaleína y análogos. [Internet]. 2020-05-13 [citado 2026-02-20]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/demostraciones-con-fenolftaleina-y-analogos/.
MLA: . "Demostraciones con fenolftaleína y análogos." https://quimicafacil.net/manual-de-laboratorio/demostraciones-con-fenolftaleina-y-analogos/. 2020-05-13. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net