Tiempo de lectura estimado: 5 minutos
La fenolftaleína es un compuesto químico con la fórmula C20H14O4 y a menudo se escribe como «HIn» o «phph» en notación abreviada. La fenolftaleína se usa a menudo como un indicador en las valoraciones ácido-base. Para esta aplicación, se vuelve incoloro en soluciones ácidas y rojo – rosado en soluciones básicas. Pertenece a la clase de colorantes conocidos como colorantes de ftaleína.
La fenolftaleína es ligeramente soluble en agua y generalmente se disuelve en alcoholes para su uso en experimentos. Es un ácido débil, que puede perder iones H+ en solución. La molécula de fenolftaleína es incolora y el ion fenolftaleína es rojo. Cuando se agrega una base a la fenolftaleína, el equilibrio cambia, lo que lleva a una mayor ionización a medida que se eliminan los iones H+ como es predicho por el principio de Le Chatelier.
La fenolftaleína tiene una interesante historia que se remonta a su descubrimiento en el año 1871 por el químico alemán Adolf von Baeyer. Inicialmente, fue utilizada como laxante durante más de un siglo antes de que surgieran preocupaciones sobre su potencial carcinogénico, lo que llevó a su eliminación de los laxantes de venta libre.
Además de su uso medicinal, la fenolftaleína se convirtió en un componente crucial en el campo de las valoraciones ácido-base, donde su sensibilidad al pH ha sido fundamental para una amplia gama de aplicaciones, desde laboratorios de química hasta la industria de la construcción. Su versatilidad y utilidad en diversos campos la han mantenido relevante a lo largo de los años.
Fenolftaleína como indicador de pH
El uso común de fenolftaleína es como un indicador en las valoraciones ácido-base. También sirve como un componente del indicador universal, junto con el rojo de metilo, el azul de bromotimol y el azul de timol.
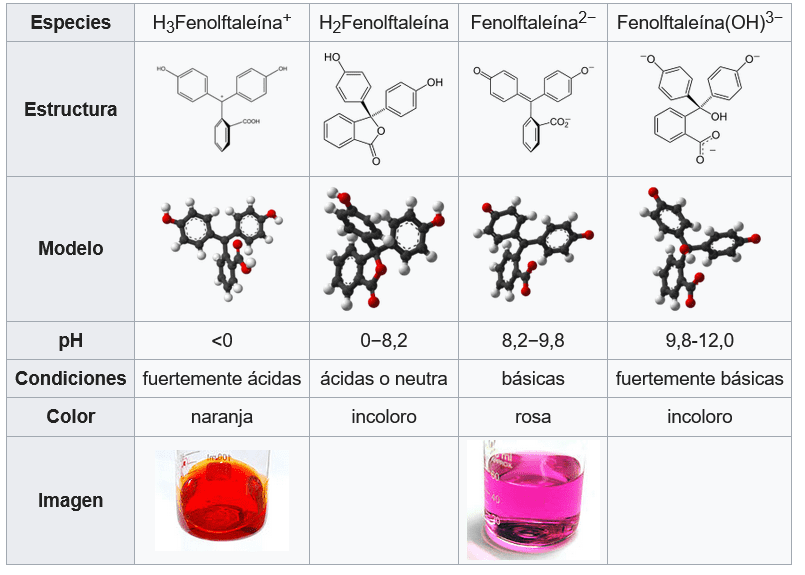
La fenolftaleína adopta cuatro estados diferentes en solución acuosa: en condiciones fuertemente ácidas, existe en forma protonada (HIn+), generando una coloración naranja. Entre condiciones fuertemente ácidas y ligeramente básicas, la forma de lactona (HIn) es incolora. La forma de fenolato doblemente desprotonado (In2-) (la forma aniónica de fenol) da el familiar color rosado. En soluciones fuertemente básicas, la fenolftaleína se convierte en su forma In(OH)3, y su color rosado experimenta una reacción de desvanecimiento bastante lenta y se vuelve completamente incolora por encima de 13.0 pH.
La sensibilidad al pH de la fenolftaleína se explota en otras aplicaciones: el concreto tiene un pH naturalmente alto debido al hidróxido de calcio que se forma cuando el cemento Portland reacciona con el agua. A medida que el concreto reacciona con dióxido de carbono en la atmósfera, el pH disminuye a 8.5-9. Cuando se aplica una solución de fenolftaleína al 1% al concreto normal, se vuelve rosa brillante. Sin embargo, si permanece incoloro, muestra que el hormigón ha sufrido carbonatación. En una aplicación similar, algunas masillas utilizadas para reparar agujeros en paneles de yeso contienen fenolftaleína. Cuando se aplica, el material de relleno conserva un color rosado; Cuando el enmascarado se ha curado por reacción con dióxido de carbono atmosférico, el color rosa se desvanece.
Otros usos
Otro de los usos de este compuesto es el médico. La fenolftaleína se ha usado durante más de un siglo como laxante, pero ahora se está eliminando de los laxantes de venta libre debido a las preocupaciones sobre su carcinogenicidad. A pesar de esto, es poco probable que el uso de fenolftaleína como laxante este relacionado con el cáncer de ovario. La fenolftaleína se ha agregado a la lista de candidatos de la Agencia Europea de Químicos para Sustancias de Muy Alta Preocupación (SVHC).
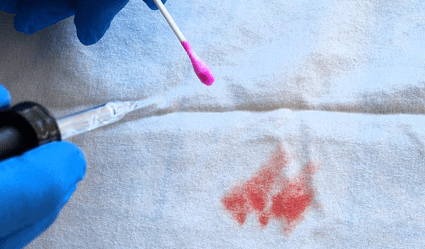
Una forma reducida de fenolftaleína, fenolftalin, que es incolora, se usa en una prueba para identificar sustancias que se cree que contienen sangre, comúnmente conocida como la prueba de Kastle-Meyer. Se recoge una muestra seca con un hisopo o papel de filtro. Unas gotas de alcohol, luego unas gotas de fenolftalin y finalmente unas gotas de peróxido de hidrógeno se agregan sobre la muestra.
Si la muestra contiene hemoglobina, se volverá rosa inmediatamente después de la adición del peróxido, debido a la generación de fenolftaleína. Una prueba positiva indica que la muestra contiene hemoglobina y, por lo tanto, es probable que sea sangre.
Un falso positivo puede resultar de la presencia de sustancias con actividad catalítica similar a la hemoglobina. Es una prueba no destructiva para la muestra, por lo tanto, se puede conservar y utilizar en otras pruebas. La misma reacción ocurre con la sangre de cualquier animal cuya sangre contiene hemoglobina, incluidos casi todos los vertebrados; se requerirían más pruebas para determinar si es de origen humano.
Para más información Phenolphthalein | C20H14O4 – PubChem
Como citar este artículo:
APA: (2019-04-02). Fenolftaleína. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/fenolftaleina/
ACS: . Fenolftaleína. https://quimicafacil.net/compuesto-de-la-semana/fenolftaleina/. Fecha de consulta 2025-07-05.
IEEE: , "Fenolftaleína," https://quimicafacil.net/compuesto-de-la-semana/fenolftaleina/, fecha de consulta 2025-07-05.
Vancouver: . Fenolftaleína. [Internet]. 2019-04-02 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/fenolftaleina/.
MLA: . "Fenolftaleína." https://quimicafacil.net/compuesto-de-la-semana/fenolftaleina/. 2019-04-02. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net