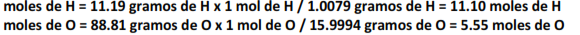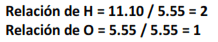Tiempo de lectura estimado: 7 minutos
Composición porcentual de los compuestos
Cuando se sintetiza o aísla un compuesto nuevo, debe ser determinada su composicion porcentual, fórmula y estructura. Actualmente existen técnicas analíticas que permiten rápidamente elucidar la composición y estructura de una nueva molécula, pero antes era un trabajo largo de laboratorio y de cálculos matemáticos y el primer paso era calcular la composición porcentual.
¿Como calcular la composición porcentual?
La composición porcentual de una nueva molécula se obtiene dividiendo la masa de cada elemento entre la masa molar del compuesto y multiplicando por 100.
Por ejemplo, en una mol de agua (peso molecular = 18.0152), hay 2 moles de H (1.0079 x 2 = 2.0158) y un mol de O (15.9994). Por lo tanto:
La fórmula empírica o fórmula más simple, es la relación más baja que expresa el número relativo de los átomos de los elementos en un compuesto. La fórmula empírica puede ser obtenida a partir de la composición porcentual como sigue: primero, suponer una cantidad definida como base del compuesto (generalmente 100 g). En el caso del agua, 11.19 g de hidrogeno, y 88.81 g de oxígeno. Ahora se convierte la masa de cada elemento a moles:
Cuando se dividen los resultados por el número de moles más pequeño que se obtuvo (5.55 en este caso) se obtiene la relación de números:
Si los números obtenidos son números enteros, se usan como subíndices al escribir la fórmula empírica. La fórmula empírica es por lo tanto H2O. Si se obtiene una fracción en las relaciones, es necesario multiplicar por algún factor para eliminar la fracción y obtener números enteros.
Fórmula molecular o verdadera
La fórmula molecular es la fórmula real o verdadera y representa el número total de átomos de cada elemento presentes en la molécula de un compuesto. Es perfectamente posible que dos o más sustancias tengan la misma composición porcentual, pero ser distintos compuestos.
Por ejemplo, suponga que se obtuvo la fórmula empírica CH a partir de la composición porcentual de un compuesto. Esta fórmula puede representar una molécula que tiene la fórmula C2H2 (acetileno), C6H6 (benceno) o cualquier múltiplo de la fórmula empírica CH; tanto el acetileno como el benceno contienen 92.3% de carbono y 7.7% de hidrógeno.
No es raro que la fórmula empírica sea la misma, pero la fórmula molecular será un múltiplo de la fórmula empírica. Para derivar la fórmula molecular a partir de la fórmula empírica debemos conocer la masa molar del compuesto.
La fórmula empírica de un compuesto puede ser determinada por análisis químico o por síntesis. En el análisis químico, una masa conocida del compuesto es descompuesta para obtener las masas de los elementos mismos o algunos de sus derivados conocidos (para el carbón, el derivado es CO2, y para el hidrógeno es el agua).
A partir de estas masas puede ser determinada la composición porcentual del compuesto para posteriormente obtener o deducir la formula de un compuesto. En una síntesis, se toman en cuenta las masas conocidas de los elementos para formar un compuesto y se determina la masa del compuesto. A partir de estos datos, es posible derivar la fórmula empírica del compuesto.
Materiales
- Soporte universal
- Triangulo de porcelana y/o placa de calentamiento
- Mechero Bunsen
- Crisol
- Pinzas para crisol
- Capsula de porcelana
- Desecador
- Papel indicador de pH
- Balanza analítica
Reactivos
- Cinta de magnesio
- Agua destilada
Procedimiento
Tiempo necesario: 50 minutos
Determinación de la composición porcentual
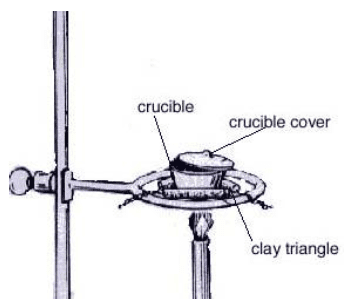
Realizar el montaje mostrado a continuación teniendo en cuenta ajustar la altura del montaje para que la punta de la flama no luminosa del mechero Bunsen toque la base del crisol.

Si es necesario, marcar el crisol en la base con ayuda de un lápiz. Pesar el crisol en una balanza analítica y anotar dicho valor. Tomar 3 cm de cinta de magnesio y enrollar sin traslapar las vueltas, colocar en el desecador y volver a pesar. Anotar el valor.
AnuncioColocar el crisol al fuego y calentar suavemente (de aquí en adelante, se debe manejar el crisol con pinzas sin importar si está frio o caliente). Se debe evitar la ignición de la cinta de magnesio, en caso de que suceda, tapar el crisol para ahogar la llama. Después que el magnesio se haya oxidado (se observa un color gris claro y aspecto de ceniza), dejar al fuego por 4 minutos más. Apagar el mechero y dejar enfriar al ambiente.
Una vez frio, añadir 2 gotas de agua y agitar. Eliminar el exceso de agua calentando a llama baja y seguir el pH de los vapores desprendidos sosteniendo un pedazo de papel indicador sostenido con la ayuda de una pinza en el vapor desprendido, un pH básico indicará el desprendimiento de amoniaco. Después que la ceniza se seque totalmente, calentar fuertemente el crisol por 2 minutos más.
Cesar el calentamiento del crisol y llevar a un desecador para dejar enfriar, pesar el crisol frio y anotar el valor. Repetir el procedimiento dos veces más.
Después del experimento
De la masa del oxido determinada en el experimento, restar la masa de metal empleada, de ahí se obtendrá la masa del oxígeno que se combinó con el metal para obtener el respectivo oxido.
Calcular los porcentajes tanto de metal como de oxido relacionando sus masas con la masa del oxido metálico, entonces, calcular las relaciones porcentuales tanto del metal como del oxigeno y determinar la formula empírica del oxido obtenido.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales.
Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Lab 2 – Determination of the Empirical Formula of Magnesium Oxide
Como citar este artículo:
APA: (2019-11-27). Determinación de la composición porcentual de un compuesto. Recuperado de https://quimicafacil.net/manual-de-laboratorio/composicion-porcentual/
ACS: . Determinación de la composición porcentual de un compuesto. https://quimicafacil.net/manual-de-laboratorio/composicion-porcentual/. Fecha de consulta 2026-02-27.
IEEE: , "Determinación de la composición porcentual de un compuesto," https://quimicafacil.net/manual-de-laboratorio/composicion-porcentual/, fecha de consulta 2026-02-27.
Vancouver: . Determinación de la composición porcentual de un compuesto. [Internet]. 2019-11-27 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/composicion-porcentual/.
MLA: . "Determinación de la composición porcentual de un compuesto." https://quimicafacil.net/manual-de-laboratorio/composicion-porcentual/. 2019-11-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net