Tiempo de lectura estimado: 4 minutos
August Beer (31 de julio de 1825 – 18 de noviembre de 1863) fue un físico, químico y matemático alemán de ascendencia judía.
Vida y educación de Beer
August Beer nació en Trier, donde estudió matemáticas y ciencias naturales. Fue educado en la escuela técnica y el gymnasium de su ciudad natal hasta 1845, cuando fue a Bonn a estudiar matemáticas y ciencias bajo la tutela del matemático y físico Julius Plücker, quien más tarde se convirtió en su asistente.
En 1848 ganó el premio por su ensayo «De Situ Axium Opticorum in Crystallis Biaxibus» y obtuvo el grado de doctor en filosofía dos años después. En 1850 fue nombrado profesor en la Universidad de Bonn.
Investigación sobre la absorción de la luz
En 1852, Beer publicó un artículo sobre la absorción de la luz roja en soluciones acuosas coloreadas de diferentes sales. Beer utiliza el hecho, derivado de las leyes de absorción de Bouguer y Lambert, de que la intensidad de la luz transmitida a través de una solución a una longitud de onda determinada disminuye exponencialmente con la longitud del camino y la concentración del soluto.
La ley de Beer-Lambert establece que la absorbancia de una solución es proporcional a la concentración del soluto ya la longitud del camino recorrido por la luz a través de la solución. Beer definió el «Coeficiente de Absorción» como la razón entre la intensidad de luz transmitida (I) y la intensidad de luz incidente (I0) en una solución.
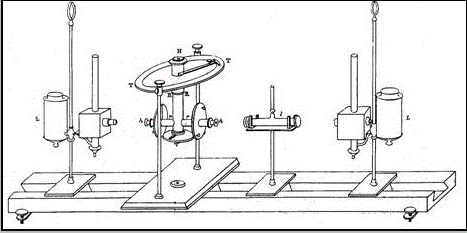
Beer realizó varios experimentos para confirmar esta ley empírica y definió una concentración estándar del 10% y una longitud del camino estándar de 10 cm. El fotómetro diseñado por Beer se muestra en la galería de imágenes.
Contribuciones y legado de Beer
Beer continuó publicando los resultados de sus investigaciones científicas, escribiendo en 1854 «Einleitung in die höhere Optik» (Introducción a la Óptica Superior). Sus hallazgos, junto con los de Johann Heinrich Lambert, forman la Ley de Beer-Lambert.
En 1855 fue nombrado profesor de matemáticas en la Universidad de Bonn. Beer también escribió «Einheit in der Electrostatik» (Unidad en la Electroestática), publicado dos años después de su muerte. Murió en Bonn en 1863, dejando un legado en el campo de la óptica y la física que sigue siendo relevante en la actualidad.
Ley de Beer-Lambert-Bouguer
La ley de Beer-Lambert-Bouguer debe su nombre a August Beer, Johann Heinrich Lambert y Pierre Bouguer, y también se conoce como ley de Beer-Lambert.
Bouguer descubrió por primera vez partes de la ley, publicadas en su Essai d’optique sur la gradation de la lumière («Ensayo de óptica sobre la gradación de la luz») en 1729. En esta obra demostró, por ejemplo, cómo disminuye la intensidad de la luz tras atravesar una determinada parte de la atmósfera.
Lambert publicó su obra “Photometria, sive de mensura et gradibus luminis, colorum et umbrae” («Fotometría, o la medida y los grados de la luz, los colores y las sombras») en 1760. Lambert demostró que la pérdida de intensidad luminosa tras atravesar un material es proporcional a la longitud del trayecto. En términos matemáticos, esto significa
A ∝ ℓ
Donde A = absorbancia, ℓ = longitud del trayecto
En 1852, Beer descubrió otra parte del rompecabezas: Descubrió que la absorbancia también es proporcional a la concentración del soluto cuando la luz atraviesa una solución, es decir:
A ∝ ℓc
Donde A = absorbancia, ℓ = longitud del camino, c = concentración
La constante de proporcionalidad se denomina coeficiente de absorción molar de la especie que absorbe la luz, dando lugar a la ley de Beer-Lambert-Bouguer:
A = ɛℓc
A = absorbancia, ɛ = coeficiente de absorción molar, ℓ = longitud del camino, c = concentración
Esta ley es útil en química analítica cuantitativa, en la que la concentración de una solución puede determinarse midiendo su absorbancia a lo largo de un trayecto fijo a una longitud de onda de luz fija cuando se conoce el coeficiente de absorción molar a esta longitud de onda. La ley puede fallar con concentraciones muy altas, con materiales que dispersan mucho la luz o con luz muy intensa.
Para más información August Beer
Como citar este artículo:
APA: (2023-07-31). August Beer. Recuperado de https://quimicafacil.net/infografias/biografias/august-beer/
ACS: . August Beer. https://quimicafacil.net/infografias/biografias/august-beer/. Fecha de consulta 2024-10-28.
IEEE: , "August Beer," https://quimicafacil.net/infografias/biografias/august-beer/, fecha de consulta 2024-10-28.
Vancouver: . August Beer. [Internet]. 2023-07-31 [citado 2024-10-28]. Disponible en: https://quimicafacil.net/infografias/biografias/august-beer/.
MLA: . "August Beer." https://quimicafacil.net/infografias/biografias/august-beer/. 2023-07-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net