Tiempo de lectura estimado: 11 minutos
En la serie de Amazon The Man in the High Castle se mezcla la distopia con la intriga y otros elementos, entre ellos el ácido pícrico.
The Man in the High Castle (El hombre en el castillo) es una serie de televisión estadounidense de historia alternativa distópica creada para el servicio de streaming Amazon Prime Video, que describe un universo paralelo en el que las potencias del Eje gobiernan el mundo tras su victoria en la Segunda Guerra Mundial.
Fue creada por Frank Spotnitz y está producida por Amazon Studios, Ridley Scott’s Scott Free Productions (con Scott como productor ejecutivo), Headline Pictures, Electric Shepherd Productions y Big Light Productions. La serie se basa libremente en la novela homónima de Philip K. Dick de 1962.
Química en la distopia
En el cuarto episodio de la segunda temporada titulado “Escalation”, el personaje de Frank Frink, interpretado por Rupert Evans, tiene que aceptar la peligrosa misión de extraer un material extremadamente peligroso procedente de una bomba japonesa sin explotar, pero veamos que es este material mortal.
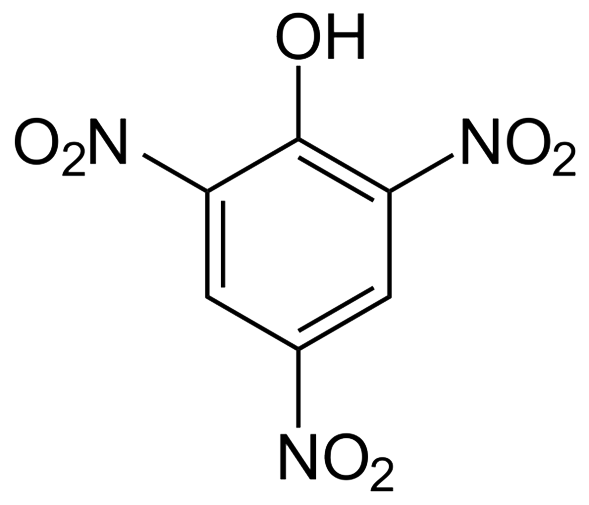
La bomba que tiene que intervenir Frank es una bomba tipo 80 usada contra instalaciones durante la segunda guerra mundial. En el capitulo se menciona que la carga de interés es el explosivo en su interior, “Shimose” o “Ooshokuyaku”, nombres que recibía el material explosivo basado en el ácido pícrico.
Historia del ácido pícrico
El ácido pícrico se menciona probablemente por primera vez en los escritos alquímicos de Johann Rudolf Glauber. Inicialmente, se fabricaba nitrando sustancias como el cuerno de los animales, la seda, el índigo y la resina natural; la síntesis a partir del índigo fue realizada por primera vez por Peter Woulfe durante 1771
El químico alemán Justus von Liebig había denominado al ácido pícrico Kohlenstickstoffsäure (traducido al francés como acide carboazotique). El químico francés Jean-Baptiste Dumas le dio ese nombre en 1841. Su síntesis a partir del fenol y la determinación correcta de su fórmula se realizaron durante 1841.
En 1799, el químico francés Jean-Joseph Welter (1763-1852) produjo ácido pícrico tratando la seda con ácido nítrico; descubrió que el picrato de potasio podía explotar. No fue hasta 1830 cuando los químicos pensaron en utilizar el ácido pícrico como explosivo. Antes de esa fecha, los químicos suponían que sólo las sales del ácido eran explosivas, no el propio ácido. En 1871, Hermann Sprengel demostró que podía ser detonado y la mayoría de las potencias militares utilizaron el ácido pícrico como su principal material de alto explosivo. El ácido pícrico también se utiliza en la química analítica de metales, menas y minerales.
Uso a gran escala
El ácido pícrico fue el primer compuesto orgánico nitrado fuertemente explosivo que se consideró adecuado para soportar el choque de los disparos en la artillería convencional. La nitroglicerina y la nitrocelulosa (algodón para armas) estaban disponibles antes, pero la sensibilidad al choque a veces provocaba la detonación en un cañón de artillería en el momento del disparo.
En 1885, basándose en las investigaciones de Hermann Sprengel, el químico francés Eugène Turpin patentó el uso de ácido pícrico prensado y fundido en las cargas de voladura y los proyectiles de artillería. El gobierno francés en 1887,adoptó una mezcla de ácido pícrico y algodón para armas con el nombre de Melinite. En 1888, Gran Bretaña comenzó a fabricar una mezcla muy similar en Lydd, Kent, con el nombre de Lyddita.
Estabilización
Japón le siguió con un enfoque de estabilización alternativo conocido como pólvora Shimose que, en lugar de intentar estabilizar el material en sí, eliminaba su contacto con el metal recubriendo el interior de los proyectiles con capas de cerámica y cera. En 1889, se empezó a fabricar una mezcla de cresilato de amonio con trinitrocresol, o una sal de amonio del trinitrocresol, con el nombre de Ecrasita en Austria-Hungría. En 1894, Rusia ya fabricaba proyectiles de artillería rellenos de ácido pícrico.
El picrato de amonio (conocido como Dunnite o explosivo D) fue utilizado por Estados Unidos a partir de 1906. Sin embargo, los proyectiles rellenos de ácido pícrico se vuelven inestables si el compuesto reacciona con las carcasas metálicas de los proyectiles o las espoletas para formar picratos metálicos que son más sensibles que el fenol original. La sensibilidad del ácido pícrico quedó demostrada en la explosión de Halifax. El ácido pícrico se utilizó en la Batalla de Omdurman, en la Segunda Guerra de los Bóers, en la Guerra Ruso-Japonesa, y en la Primera Guerra Mundial.
Alemania comenzó a llenar los proyectiles de artillería con Trinitrotolueno (TNT) en 1902. El tolueno era menos fácil de conseguir que el fenol, y el TNT es menos potente que el ácido pícrico, pero la mejora de la seguridad en la fabricación y el almacenamiento de las municiones hizo que se sustituyera este ácido por TNT para la mayoría de los fines militares entre las guerras mundiales.
Activo de guerra valioso
Los esfuerzos por controlar la disponibilidad del fenol, el precursor del ácido pícrico, ponen de relieve su importancia en la Primera Guerra Mundial. Se dice que los alemanes compraron suministros estadounidenses de fenol y lo convirtieron en ácido acetilsalicílico, es decir, en aspirina, para alejarlo de los Aliados.
En aquella época, el fenol se obtenía del carbón como coproducto de los hornos de coque y de la fabricación de gas para el alumbrado de gas. Laclede Gas informa que se le pidió que ampliara la producción de fenol (y tolueno) para ayudar al esfuerzo de guerra. Tanto Monsanto como Dow Chemical comenzaron a fabricar fenol sintético en 1915, siendo Dow el principal productor. Dow describe este compuesto como «el principal explosivo del campo de batalla utilizado por los franceses». Grandes cantidades [de fenol] también iban a Japón, donde se convertía en ácido pícrico que se vendía a los rusos».
Thomas Edison necesitaba fenol para fabricar discos fonográficos. Respondió emprendiendo la producción de fenol en sus instalaciones de Silver Lake, NJ, utilizando procesos desarrollados por sus químicos.
Construyó dos plantas con una capacidad de seis toneladas de fenol al día. La producción comenzó la primera semana de septiembre, un mes después del inicio de las hostilidades en Europa. Construyó dos plantas para producir benceno como materia prima en Johnstown, Pensilvania, y en Bessemer, Alabama, sustituyendo los suministros que anteriormente procedían de Alemania.
Edison también fabricó tintes de anilina, que anteriormente habían sido suministrados por el consorcio alemán de tintes. Otros productos en tiempos de guerra fueron el xileno, la p-fenilendiamina, la goma laca y el pirax. La escasez en tiempos de guerra hizo que estas empresas fueran rentables. En 1915, su capacidad de producción estaba totalmente comprometida a mediados de año.
Síntesis
El anillo aromático del fenol se activa hacia las reacciones de sustitución electrofílica, y el intento de nitración del fenol, incluso con ácido nítrico diluido, da lugar a la formación de alquitranes de alto peso molecular. Para minimizar estas reacciones secundarias, el fenol anhidro se sulfona con ácido sulfúrico fumante, y el ácido p-hidroxifenilsulfónico resultante se nitra con ácido nítrico concentrado.
Durante esta reacción, se introducen grupos nitro y se desplaza el grupo ácido sulfónico. La reacción es muy exotérmica y se requiere un cuidadoso control de la temperatura. Otro método de síntesis del ácido pícrico es la nitración directa del 2,4-dinitrofenol con ácido nítrico. Cristaliza en el grupo espacial ortorrómbico Pca21 con a = 9,13 Å, b = 18,69 Å, c = 9,79 Å y α = β = γ = 90°.
Usos del ácido pícrico
El mayor uso ha sido, con mucho, en municiones y explosivos. El explosivo D, también conocido como Dunnita, es la sal de amonio del ácido pícrico. La dunnita es más potente pero menos estable que el explosivo más común, el TNT (que se produce mediante un proceso similar al del ácido pícrico, pero con tolueno como materia prima). La picramida, formada por la aminación del ácido pícrico (que suele comenzar con la dunnita), puede aminarse aún más para producir el explosivo muy estable TATB.

Se ha encontrado algún uso en la química orgánica para la preparación de sales cristalinas de bases orgánicas (picratos) con el fin de identificarlas y caracterizarlas.
En metalurgia, el ácido pícrico al 4% en etanol, denominado «picral», se ha utilizado comúnmente en la metalografía óptica para revelar los límites de grano de la austenita en los aceros ferríticos. Los riesgos asociados al ácido pícrico han hecho que se sustituya en gran medida por otros grabadores químicos. Sin embargo, todavía se utiliza para grabar aleaciones de magnesio, como la AZ31.
En histología se puede encontrar el ácido pícrico en la solución de Bouin, una solución fijadora que se utiliza para muestras de histología. Mejora la tinción de los colorantes ácidos, pero también puede provocar la hidrólisis de cualquier ADN de la muestra.
Las pruebas de laboratorio de química clínica utilizan el ácido pícrico para la reacción de Jaffe para analizar la creatinina. Forma un complejo coloreado que puede medirse mediante espectroscopia.
El ácido pícrico forma un isopurpurato rojo con el cianuro de hidrógeno (HCN). Mediante la medición fotométrica del colorante resultante, el ácido pícrico puede utilizarse para cuantificar el cianuro de hidrógeno.
Usos poco comunes
Con mucha menos frecuencia, el ácido pícrico húmedo se ha utilizado como tinte para la piel, o agente de marca temporal. Reacciona con las proteínas de la piel para dar un color marrón oscuro que puede durar hasta un mes.
A principios del siglo XX, el ácido pícrico se almacenaba en las farmacias como antiséptico y como tratamiento para las quemaduras, la malaria, el herpes y la viruela. Las gasas empapadas en este compuesto también se almacenaban habitualmente en los botiquines de esa época como tratamiento de las quemaduras.
Se utilizó especialmente para el tratamiento de las quemaduras sufridas por las víctimas del desastre del Hindenburg en 1937. También se utilizó como tratamiento para el pie de trinchera de los soldados destinados en el Frente Occidental durante la Primera Guerra Mundial.
El ácido pícrico ha sido utilizado durante muchos años por los fabricantes de señuelos para teñir las pieles de topo y las plumas de un verde oliva oscuro para utilizarlas como señuelos de pesca. Su popularidad se ha visto mermada por su carácter tóxico.
A principios del siglo XX, el ácido pícrico se utilizaba para medir los niveles de glucosa en sangre. Cuando la glucosa, el ácido pícrico y el carbonato sódico se combinan y se calientan, se forma un color rojo característico. Con una solución de glucosa calibrada, el color rojo puede utilizarse para medir los niveles de glucosa añadidos. Esto se conoce como el método de Lewis y Benedict para medir la glucosa.
Seguridad en el manejo del ácido pícrico
Las precauciones de seguridad modernas recomiendan almacenar el ácido pícrico en húmedo, para minimizar el peligro de explosión. El ácido pícrico seco es relativamente sensible a los golpes y la fricción, por lo que los laboratorios que lo utilizan lo almacenan en botellas bajo una capa de agua, lo que lo hace seguro.
Se necesitan botellas de vidrio o plástico, ya que este compuesto puede formar fácilmente sales metálicas de picrato que son aún más sensibles y peligrosas que el propio ácido. Industrialmente, el ácido pícrico es especialmente peligroso porque es volátil y se sublima lentamente incluso a temperatura ambiente. Con el tiempo, la acumulación de picratos en superficies metálicas expuestas puede constituir un peligro de explosión.
Desactivando explosivos del pasado
Las gasas con ácido pícrico, si se encuentran en botiquines antiguos, suponen un peligro para la seguridad porque el ácido de esa época (60-90 años) se habrá cristalizado y será inestable, y puede haber formado picratos de metal por su largo almacenamiento en un botiquín metálico.
Las unidades de desactivación de bombas suelen ser llamadas para deshacerse de este compuesto si se ha secado. En Estados Unidos hubo un esfuerzo por retirar los envases de ácido pícrico seco de los laboratorios de las escuelas secundarias durante la década de 1980.
Las municiones que contienen ácido pícrico pueden encontrarse en buques de guerra hundidos. La acumulación de picratos metálicos con el tiempo los hace sensibles a los golpes y extremadamente peligrosos. Se recomienda no perturbar en modo alguno los pecios que contengan este tipo de municiones. El peligro puede disminuir cuando los cascos se corroen lo suficiente como para admitir agua de mar, ya que estos materiales son solubles en agua. Actualmente existen varias sondas fluorescentes para percibir y detectar el ácido pícrico en cantidades muy diminutas.
Para más información Picric Acid
Como citar este artículo:
APA: (2022-06-16). The Man in the High Castle – ácido pícrico. Recuperado de https://quimicafacil.net/la-quimica-en-el-celuloide/the-man-in-the-high-castle-acido-picrico/
ACS: . The Man in the High Castle – ácido pícrico. https://quimicafacil.net/la-quimica-en-el-celuloide/the-man-in-the-high-castle-acido-picrico/. Fecha de consulta 2026-03-05.
IEEE: , "The Man in the High Castle – ácido pícrico," https://quimicafacil.net/la-quimica-en-el-celuloide/the-man-in-the-high-castle-acido-picrico/, fecha de consulta 2026-03-05.
Vancouver: . The Man in the High Castle – ácido pícrico. [Internet]. 2022-06-16 [citado 2026-03-05]. Disponible en: https://quimicafacil.net/la-quimica-en-el-celuloide/the-man-in-the-high-castle-acido-picrico/.
MLA: . "The Man in the High Castle – ácido pícrico." https://quimicafacil.net/la-quimica-en-el-celuloide/the-man-in-the-high-castle-acido-picrico/. 2022-06-16. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net