Tiempo de lectura estimado: 9 minutos
Muchos, especialmente los novatos y no especialistas piensan que la química es cuando «suena, brilla y reluce» pero «también cuando huele mal». De hecho, la nariz de un químico sintético que trabaja en un gran laboratorio se somete a pruebas serias todos los días. Después de todo, algunas sustancias, incluso en cantidades muy pequeñas, pueden expulsar a una persona de la habitación. ¿Qué sustancias tienen el olor más desagradable y a cuáles es más sensible la nariz humana?
La afinidad por los malos olores
Se cree que los seres humanos son más sensibles a los olores desagradables. Por ejemplo, el ácido graso libre, al igual que todos los ácidos carboxílicos con un pequeño número de átomos de carbono, huele horrible. Por lo tanto, cuando el aceite se echa a perder, se liberan ácido graso y otros ácidos que le dan un olor y sabor desagradables (rancio). Pero aquí hay otro ejemplo. El ajo y la cebolla huelen fuerte porque liberan compuestos sulfurados: el ajo principalmente contiene dialildisulfuro (CH2 = CH-CH2-S-S-CH2-CH = CH2) y alicina (del nombre cientifico del ajo Allium sativum) CH2 = CH-CH2-S-O-S-CH2-CH = CH2, la cebolla contiene alilpropildisulfuro CH2 = CH-CH2-S-S-CH2-CH = CH2. De hecho, no hay estos compuestos en el ajo y la cebolla, pero hay muchos aminoácidos de cisteína con grupos sulfhidrilos -SH.
Al cortar el ajo o la cebolla, estos aminoácidos se convierten en disulfuros fragantes bajo la acción de enzimas. En la cebolla, también se forma sulfóxido de tiopropanal S- CH3-CH2-CH = S = O, un potente lacrimógeno que causa lagrimeo. Estos disulfuros tienen una característica única. Muchos han notado que es casi imposible deshacerse del olor de la cebolla o el ajo: ni cepillarse los dientes ni enjuagarse la boca ayudan. Y el asunto es que estos compuestos se forman en los pulmones. Los disulfuros, al penetrar desde los alimentos en las paredes del intestino y luego en la sangre, se distribuyen por todo el cuerpo, incluidos los pulmones. Allí son liberados junto con el aire exhalado.
Mercaptanos y otros terrores olfativos
Uno de los olores más desagradables proviene de los tioles, o mercaptanos R-SH (el segundo nombre refleja la capacidad de estos compuestos para capturar mercurio, en inglés mercury capture). Al gas natural, que se quema en la estufa de la cocina (principalmente metano), se le agregan pequeñísimas cantidades de sustancias de olor muy fuerte, como el isoamilmercaptano (CH3)2CH-CH2-CH2-SH, para que se pueda detectar una fuga de gas por el olor en espacios residenciales: una persona es capaz de percibir el olor de este compuesto en cantidades de dos billonésimas partes de gramo.
Sin embargo, en ocasiones hay personas (aproximadamente 1 de cada 1000) que no perciben el olor de los mercaptanos. Tal vez esto explique parcialmente los casos de explosiones debido a fugas de gas. La «ceguera olfativa», científicamente llamada anosmia (del griego osme – olor), en ocasiones afecta a todos los olores, pero más a menudo solo a ciertos olores específicos (anosmia específica). Así, el 2% de la población no percibe el dulce olor del ácido isovalérico, el 10% no percibe el olor del venenoso ácido cianhídrico, el 12% no percibe el olor del almizcle, el 36% el de la malta y el 47% el de la hormona androsterona.
Los mercaptanos son las sustancias químicas que confieren el olor desagradable a la emanación de la mofeta, un pequeño animal de la familia de los mustélidos. Existen casos en los que las personas han perdido el conocimiento después de inhalar las secreciones de estos animales, e incluso experimentaron dolores de cabeza al día siguiente. En 1975, K.K. Andersen y D.T. Bernstein analizaron detalladamente las secreciones de la mofeta y descubrieron la presencia de 3-metilbutantiol (isopentilmercaptano) (CH3)2CH-CH2-CH2-SH, trans-2-buten-1-tiol (crotalmercaptano) CH3-CH=CH-CH2-SH, y trans-2-butenil-etildisulfuro CH3-CH=CH-CH2-S-S-CH3.
Pero hay olores aún peores. En el famoso Libro Guinness de los Récords, los compuestos químicos más malolientes incluyen etilmercaptano C2H5SH y butilselenomercaptano C4H9SeN – su olor es una combinación de olor a col podrida, ajo, cebolla y suciedad al mismo tiempo. Algunos autores afirman que el olor de los mercaptanos es uno de los olores más desagradables y fuertes que se encuentran en las sustancias orgánicas. El metilmercaptano CH3SH se forma durante la hidrólisis de la queratina del pelo y la descomposición de las sustancias proteicas que contienen azufre. También se encuentra en las heces humanas y, junto con el escatol (beta-metilindol), es la causa del mal olor de estas.
Normalmente, los malos olores se eliminan usando un desodorante más fuerte, lo cual puede, con el tiempo, convertirse en la causa de asociaciones desagradables. Sin embargo, en 1989, el estadounidense K.J. Wisner patentó un «champú contra la mofeta» que contiene una solución al 2% de iodato de potasio KIO3. Este compuesto oxida fácilmente los mercaptanos y disulfuros a sulfóxidos, sulfatos o sulfonas, los cuales no tienen olor.
La sensibilidad al olor
A pesar de todo, el récord de sensibilidad pertenece a una sustancia con un aroma agradable. El Libro Guinness de los Récords afirma que esta sustancia es la vainillina: su presencia en el aire se puede sentir a una concentración de 2 * 10-11 g por litro. Sin embargo, este récord fue superado relativamente recientemente.
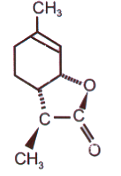
El nuevo poseedor del récord es una lactona encontrada en el vino, que, según demostró en 1996 el químico suizo H. Gut, le da a los vinos blancos y rojos un aroma dulce y «coco». Es sorprendente la sensibilidad del olfato a esta sustancia: se puede sentir a una concentración de 0.01 picogramos (10-14, o una cien billonésima de gramo) en 1 litro de aire. Es igualmente sorprendente que esta característica solo sea propia de uno de los isómeros espaciales de la lactona – aquel que se muestra en la figura. ¡El olor de su antípoda solo se puede sentir a una concentración de 1 mg / l, que es 11 órdenes de magnitud mayor!
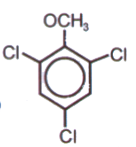
Como de costumbre, siempre hay un «pero». Por ejemplo, el 2,4,6-tricloroanisol le da a los vinos (por supuesto, no los de mejor calidad) un aroma a «corcho». Los expertos catadores pueden detectar la presencia de este compuesto incluso a una concentración de 10 ng (nanogramos) por litro. Afortunadamente, esto es 6 órdenes de magnitud mayor que en el caso de lactona encontrada en el vino que se mencionó anteriormente. Se sugiere que el tricloroanisol se forma en la tapa de corcho de la botella debido a la acción de microorganismos. No se puede descartar que el origen de esta sustancia sea el uso de insecticidas que contienen cloro para combatir plagas en las bodegas de vino.
Persistencia
Otros compuestos aromáticos conocidos no se quedan atrás de los campeones en cuanto a su persistencia. En la ciudad de Marrakech (Marruecos) se encuentra el minarete, una torre de unos 70 metros de altura construida por orden de un sultán para conmemorar su victoria sobre los españoles. El minarete es famoso por tener paredes con olor a almizcle.
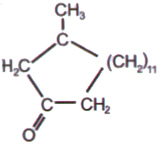
El almizcle natural es un perfume valioso producido por las glándulas de los machos de la familia de los ciervos llamados cabargús. El olor del almizcle es producido por 3-metilciclopentadecanona-1. Resulta que, durante la construcción del minarete en 1195, se mezclaron alrededor de mil bolsas de almizcle en el cemento que unía las piedras. Y el olor no ha desaparecido incluso después de 800 años.
La capacidad de oler
Si para determinar a los campeones del olor se utilizaran no solo el sentido del olfato humano, los resultados cambiarían significativamente. Por ejemplo, se sabe que el olfato de los perros es mucho más agudo que el nuestro. Los órganos olfativos de los insectos son aún más sensibles. Las feromonas son sustancias químicas especiales que les sirven como señales. La sensibilidad a las feromonas es sorprendente.
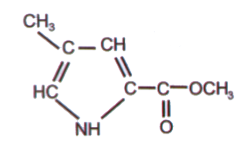
Por ejemplo, las hormigas Atta texana usan éter metílico del ácido 4-metilpirrol-2-carboxílico para marcar sus senderos. Solo un miligramo de este compuesto podría ser suficiente para marcar un sendero tres veces más largo que el ecuador terrestre. Las hormigas tienen que sintetizar solo 3 ng de este compuesto en toda su vida. Las mariposas son aún más sensibles a las feromonas; los machos pueden detectar la presencia de hembras a varios kilómetros de distancia. Algunas mariposas detectan feromonas si hay solo una molécula en 1 cm3 de aire. Para comparación, podemos detectar la lactona de vino a una concentración de 10-17 g/cm3, lo que equivale a 45,000 moléculas/cm3 con una masa molecular de 134.
Las feromonas suelen tener una masa molecular de entre 100 y 300. El agente de señalización más simple en términos de estructura es el dióxido de carbono (CO2). Este actúa como feromona para algunas especies de hormigas. Cuando las hormigas obreras se alejan del nido, encuentran su camino de regreso siguiendo la dirección del aumento de la concentración de CO2, que es máxima cerca del grupo de hormigas. Este gas también atrae las larvas de algunos gusanos que se alimentan de raíces de maíz. Después de eclosionar, las larvas diminutas pueden avanzar hasta 1 metro en busca de alimento, guiadas por el «olor» del CO2 emitido por las raíces de las plantas en el suelo.
Las interacciones entre las higueras, sus frutos y las avispas del higo que viven en ellos son muy interesantes. Cuando los higos maduran, la concentración de CO2 en las bayas aumenta en un 10%. Esto es suficiente para adormecer a las avispas hembra. Los machos, por otro lado, permanecen activos, fertilizan a las hembras y salen volando al exterior, creando un agujero en la baya. A través de estos agujeros, el exceso de CO2 se disipa, las hembras se despiertan y también abandonan las bayas, llevando consigo el polen de la planta en sus cerdas.
Para más información Chemists and bad smells (and sulfur): A productive pairing
Como citar este artículo:
APA: (2023-07-27). La química de los olores. Recuperado de https://quimicafacil.net/notas-de-quimica/la-quimica-de-los-olores/
ACS: . La química de los olores. https://quimicafacil.net/notas-de-quimica/la-quimica-de-los-olores/. Fecha de consulta 2024-07-27.
IEEE: , "La química de los olores," https://quimicafacil.net/notas-de-quimica/la-quimica-de-los-olores/, fecha de consulta 2024-07-27.
Vancouver: . La química de los olores. [Internet]. 2023-07-27 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/notas-de-quimica/la-quimica-de-los-olores/.
MLA: . "La química de los olores." https://quimicafacil.net/notas-de-quimica/la-quimica-de-los-olores/. 2023-07-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net