Tiempo de lectura estimado: 7 minutos
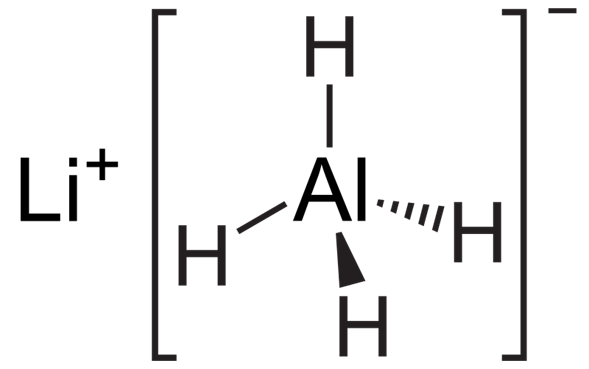
El hidruro de aluminio y litio, comúnmente abreviado como LAH, es un compuesto inorgánico con la fórmula química Li[AlH4] o LiAlH4. Es un sólido blanco, descubierto por Finholt, Bond y Schlesinger en 1947.
Este compuesto se utiliza como agente reductor en síntesis orgánica, especialmente para la reducción de ésteres, ácidos carboxílicos y amidas. El sólido es peligrosamente reactivo con el agua, liberando hidrógeno gaseoso (H2). Se ha discutido sobre algunos derivados relacionados para el almacenamiento de hidrógeno.
Características y propiedades químicas del LAH
El LAH es un sólido incoloro, pero las muestras comerciales suelen ser grises debido a la contaminación. Este material se puede purificar mediante recristalización en éter dietílico. Las purificaciones a gran escala utilizan un extractor Soxhlet.
Comúnmente, se utiliza el material gris impuro en la síntesis, ya que las impurezas son inofensivas y se pueden separar fácilmente de los productos orgánicos. El material en polvo puro es pirofórico, pero no lo son sus grandes cristales. Algunos materiales comerciales contienen aceite mineral para inhibir reacciones con la humedad atmosférica, pero más comúnmente se empaqueta en bolsas de plástico a prueba de humedad.
El LAH reacciona violentamente con el agua, incluida la humedad atmosférica, para liberar gas dihidrógeno. La reacción procede de acuerdo con la siguiente ecuación:
Esta reacción proporciona un método útil para generar hidrógeno en el laboratorio. Las muestras envejecidas y expuestas al aire a menudo aparecen blancas porque han absorbido suficiente humedad para generar una mezcla de los compuestos blancos hidróxido de litio e hidróxido de aluminio.
Preparación
El Li[AlH4] se preparó por primera vez a partir de la reacción entre hidruro de litio (LiH) y cloruro de aluminio.
Además de este método, la síntesis industrial implica la preparación inicial de hidruro de sodio y aluminio a partir de los elementos bajo alta presión y temperatura:
El Li[AlH4] se prepara luego mediante una reacción de metátesis de sal de acuerdo con:
que procede con un alto rendimiento. El LiCl se elimina por filtración de una solución etérea de LAH, con la posterior precipitación de LAH para obtener un producto que contiene alrededor del 1% en peso de LiCl.
Una preparación alternativa comienza con LiH y Al metálico en lugar de AlCl3. Catalizada por una pequeña cantidad de TiCl3 (0.2%), la reacción procede bien utilizando éter dimetílico como disolvente. Este método evita la cogeneración de sal.
Aplicaciones del hidruro de litio y aluminio
Las aplicaciones del LAH son múltiples en química orgánica e inorgánica, gracias a su versatilidad
Aplicaciones en química orgánica
El hidruro de aluminio y litio (LAH) se usa ampliamente en química orgánica como agente reductor. Es más potente que el reactivo relacionado, el borohidruro de sodio, debido al enlace Al-H más débil en comparación con el enlace B-H. A menudo, como solución en éter etílico y seguido por un tratamiento ácido, convertirá ésteres, ácidos carboxílicos, cloruros de acilo, aldehídos y cetonas en los alcoholes correspondientes.
De manera similar, convierte amidas, nitro, nitrilos, iminas, oximas y azidas orgánicas en aminas. Reduce cationes de amonio cuaternario en las aminas terciarias correspondientes. La reactividad puede ajustarse reemplazando grupos hidruro por grupos alcoxi.
Debido a su naturaleza pirofórica, inestabilidad, toxicidad, corta vida útil y problemas de manipulación asociados con su reactividad, ha sido reemplazado en la última década, tanto a escala industrial pequeña como para reducciones a gran escala, por el más conveniente reactivo relacionado, el hidruro de aluminio y sodio bis(2-metoxietoxi), que presenta una reactividad similar, pero con una mayor seguridad, una manipulación más fácil y una mejor economía.
El LAH se usa más comúnmente para la reducción de ésteres y ácidos carboxílicos a alcoholes primarios. Antes de la llegada del LAH, esta era una conversión difícil que implicaba sodio metálico en etanol en ebullición (la reducción de Bouveault-Blanc).
Aldehídos y cetonas también pueden reducirse a alcoholes con LAH, pero esto generalmente se hace utilizando reactivos más suaves como Na[BH4]; las cetonas α, β-insaturadas se reducen a alcoholes alílicos. Cuando los epóxidos se reducen con LAH, el reactivo ataca el extremo menos impedido del epóxido, produciendo generalmente un alcohol secundario o terciario. Los epoxiciclohexanos se reducen para dar preferentemente alcoholes axiales.
La reducción parcial de cloruros de ácido para dar el aldehído correspondiente no puede proceder a través de LAH, ya que este reduce hasta el alcohol primario. En su lugar, se debe usar el hidruro de litio tri-terbutoxialuminio más suave, que reacciona significativamente más rápido con el cloruro de ácido que con el aldehído. Por ejemplo, cuando el ácido isovalérico se trata con cloruro de tionilo para dar cloruro de isovaleroílo, se puede reducir a través del hidruro de litio tri-terbutoxialuminio para dar isovaleraldehído en un rendimiento del 65%.
El hidruro de aluminio y litio también reduce haluros de alquilo a alcanos. Los yoduros de alquilo reaccionan más rápido, seguidos por los bromuros y luego los cloruros. Los haluros primarios son los más reactivos, seguidos por los haluros secundarios. Los haluros terciarios solo reaccionan en ciertos casos.
El hidruro de aluminio y litio no reduce alquenos o arenes simples. Los alquinos se reducen solo si hay un grupo alcohol cercano. Se observó que LiAlH4 reduce el doble enlace en las N-alilamidas.
Química inorgánica
El LAH se utiliza ampliamente para preparar hidruros de metales principales y de transición a partir de los haluros de metal correspondientes. También reacciona con muchos ligandos inorgánicos para formar complejos coordinados de alúmina asociados con iones de litio.
El LAH como medio de almacenamiento de hidrógeno
El LiAlH4 contiene un 10.6% en peso de hidrógeno, lo que hace que LAH sea un posible medio de almacenamiento de hidrógeno para futuros vehículos propulsados por celdas de combustible. El alto contenido de hidrógeno, así como el descubrimiento del almacenamiento reversible de hidrógeno en NaAlH4 dopado con Ti, han impulsado la investigación renovada sobre LiAlH4 durante la última década.
Se ha dedicado un esfuerzo sustancial de investigación a acelerar la cinética de descomposición mediante dopaje catalítico y molienda de bolas. Para aprovechar la capacidad total de almacenamiento de hidrógeno, el compuesto intermedio LiH también debe deshidrogenarse.
Debido a su alta estabilidad termodinámica, esto requiere temperaturas superiores a los 400 °C, lo cual no se considera factible para fines de transporte. Aceptando LiH + Al como el producto final, la capacidad de almacenamiento de hidrógeno se reduce al 7.96% en peso.
Otro problema relacionado con el almacenamiento de hidrógeno es el reciclaje de vuelta a LiAlH4, que, debido a su estabilidad relativamente baja, requiere una presión de hidrógeno extremadamente alta de más de 10,000 bares. El reciclaje solo de la reacción R2, es decir, utilizando Li3AlH6 como material de partida, almacenaría un 5.6% en peso de hidrógeno en un solo paso (en comparación con dos pasos para NaAlH4, que almacena aproximadamente la misma cantidad de hidrógeno). Sin embargo, hasta ahora no se han tenido éxitos en intentos de este proceso.
Para más información Reagent of the month: Lithium Aluminium hydride
Como citar este artículo:
APA: (2024-01-30). Hidruro de litio y aluminio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/hidruro-de-litio-y-aluminio/
ACS: . Hidruro de litio y aluminio. https://quimicafacil.net/compuesto-de-la-semana/hidruro-de-litio-y-aluminio/. Fecha de consulta 2026-03-07.
IEEE: , "Hidruro de litio y aluminio," https://quimicafacil.net/compuesto-de-la-semana/hidruro-de-litio-y-aluminio/, fecha de consulta 2026-03-07.
Vancouver: . Hidruro de litio y aluminio. [Internet]. 2024-01-30 [citado 2026-03-07]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/hidruro-de-litio-y-aluminio/.
MLA: . "Hidruro de litio y aluminio." https://quimicafacil.net/compuesto-de-la-semana/hidruro-de-litio-y-aluminio/. 2024-01-30. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net