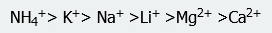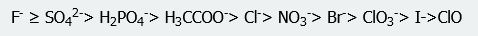Actualizado en enero 8, 2024
Tiempo de lectura estimado: 7 minutos
El salting out (también conocido como precipitación inducida por sal, fraccionamiento de la sal, cristalización antisolvente, cristalización por precipitación o ahogamiento) es una técnica de purificación que utiliza la solubilidad reducida de ciertas moléculas en una solución de muy alta fuerza iónica. El ahogamiento se utiliza normalmente para precipitar grandes biomoléculas, como las proteínas o el ADN.
Dado que la concentración de sal necesaria para que una proteína determinada precipite fuera de la solución difiere de una proteína a otra, se puede utilizar una concentración de sal específica para precipitar una proteína objetivo. Este proceso también se utiliza para concentrar soluciones diluidas de proteínas.
La salazón es un método de purificación que utiliza la solubilidad reducida de ciertas moléculas en una solución de muy alta fuerza iónica. La salazón es típicamente, pero no se limita a, la precipitación de grandes biomoléculas como las proteínas.
A diferencia del salting in, el salting out se produce en soluciones acuosas de alta fuerza iónica que reducen la solubilidad de la molécula y hacen que ciertas proteínas precipiten. Idealmente, el tipo de sal que se utiliza y la concentración de la misma pueden variar para precipitar selectivamente una molécula. En realidad, la salazón es un medio eficaz para la purificación inicial de la molécula, pero carece de la capacidad para el aislamiento preciso de una proteína específica.
El mecanismo detrás del salting out
La conformación de las grandes biomoléculas in vivo suele estar controlada por interacciones hidrofóbicas e hidrofílicas con el entorno celular. Estas interacciones rigen en gran medida la conformación final de la molécula al plegarse de forma que la mayoría de los grupos funcionales hidrofóbicos queden protegidos del entorno celular polar. Para lograr esta conformación, la molécula se pliega de tal manera que todas las partes hidrofóbicas de una molécula se agregan juntas y los grupos hidrofílicos se dejan para interactuar con el agua.
En el caso de las proteínas, son los aminoácidos cargados los que permiten que se produzca una salinización selectiva. Los aminoácidos cargados y polares, como el glutamato, la lisina y la tirosina, necesitan que las moléculas de agua los rodeen para permanecer disueltos.
En un entorno acuoso con una fuerza iónica elevada, las moléculas de agua rodean las cargas de los iones y las proteínas. A partir de una determinada fuerza iónica, las moléculas de agua ya no son capaces de soportar las cargas de los iones y las proteínas. El resultado es la precipitación del soluto menos soluble, como las proteínas y las grandes moléculas orgánicas.
La serie Hoffmeister
El salting out puede ser una poderosa herramienta para separar clases de proteínas que varían en tamaño, carga y superficie, entre otras características. Un método para controlar la precipitación es utilizar los diferentes efectos de varias sales y sus respectivas concentraciones.
La capacidad de una sal para inducir una precipitación selectiva depende de muchas interacciones con el agua y los solutos. Las investigaciones realizadas por Franz Hofmeister a principios del siglo XX organizaron varios aniones y cationes según su capacidad.
La ordenación de cationes y aniones se denomina serie de Hoffmeister. Los cationes se ordenan de la siguiente manera
donde el amonio tiene la mayor capacidad de precipitar otros solutos proteicos. Del mismo modo, el orden de los aniones es
Entre los cationes y los aniones en solución, la concentración del anión suele tener el mayor efecto sobre la precipitación de las proteínas.
Una de las sales más utilizadas es el sulfato de amonio, que se suele emplear porque los iones producidos en una solución acuosa son muy altos en la serie de Hofmeister, y su interacción con la propia proteína es relativamente baja. Otros iones, como el yoduro, son muy buenos para precipitar proteínas, pero no se utilizan debido a su propensión a desnaturalizar o modificar la proteína.
Uso del Salting out en el laboratorio
Las soluciones iónicas saturadas pueden utilizarse para disminuir la solubilidad de los compuestos orgánicos en la capa acuosa, permitiendo que una mayor cantidad de un compuesto se disuelva en la capa orgánica. Si un producto deseado puede formar un enlace de hidrógeno con el agua y es relativamente pequeño, puede ser difícil mantenerlo en la capa orgánica cuando se particiona con una fase acuosa (K será <1).
Sin embargo, el equilibrio puede favorecer la capa orgánica si todos los lavados acuosos contienen altas concentraciones de iones (por ejemplo, NaHCO3, NaCl o NH4Cl saturados). Al estar el agua tan «ocupada» en la disolución de los iones en estas soluciones, son menos capaces de disolver los compuestos orgánicos. Además, las soluciones iónicas tienen constantes dieléctricas elevadas, lo que las hace menos compatibles con los compuestos orgánicos.
La figura 2 muestra cómo la salmuera afecta a la partición del colorante alimentario rojo en acetato de etilo y en soluciones acuosas. La figura 2a muestra la adición de una gota de colorante alimentario rojo a una capa de agua en un embudo de separación, y el colorante se disuelve fácilmente incluso sin agitación.
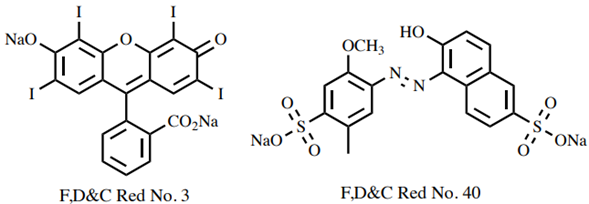
La figura 2b muestra la capa de agua que contiene el colorante después de agitarla con una porción de acetato de etilo. La capa orgánica sólo tiene un color rosa muy tenue, lo que significa que se ha disuelto poco tinte. Es evidente que el colorante se ha repartido hacia la capa acuosa, lo que es coherente con su estructura muy polar (Figura 1).
La figura 2c muestra la adición de una gota de colorante alimentario rojo a una solución de salmuera, y el colorante no parece mezclarse con la salmuera en absoluto. La figura 2d muestra la capa de salmuera que contiene el colorante después de agitarla con una porción de acetato de etilo. Las moléculas polares del colorante son mucho menos solubles en la solución de salmuera que en el agua pura (se han «Salting out«). De hecho, parte del colorante se precipitó en el embudo (Figura 2d), ya que tenía una solubilidad tan baja tanto en la salmuera como en el acetato de etilo.

Figura 2: a) Agua con la adición de una gota de colorante alimentario rojo, antes de agitar, b) Acetato de etilo, agua y colorante en equilibrio, c) Salmuera con la adición de una gota de colorante alimentario rojo, antes de agitar, d) Acetato de etilo, salmuera y colorante en equilibrio.
Para más información Salting Out
Como citar este artículo:
APA: (2022-02-16). Salting out. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/salting-out/
ACS: . Salting out. https://quimicafacil.net/tecnicas-de-laboratorio/salting-out/. Fecha de consulta 2024-07-27.
IEEE: , "Salting out," https://quimicafacil.net/tecnicas-de-laboratorio/salting-out/, fecha de consulta 2024-07-27.
Vancouver: . Salting out. [Internet]. 2022-02-16 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/salting-out/.
MLA: . "Salting out." https://quimicafacil.net/tecnicas-de-laboratorio/salting-out/. 2022-02-16. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net