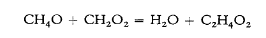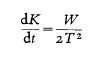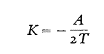Tiempo de lectura estimado: 14 minutos
El Premio Nobel de Química de 1901 fue otorgado a Jacobus H. van ‘t Hoff, un químico neerlandés, por su trabajo pionero en dinámica química y presión osmótica en soluciones. Su descubrimiento de las leyes de equilibrio químico y la presión osmótica en soluciones fue un avance importante en el campo de la química y sentó las bases para la química física moderna. Su trabajo ha tenido un impacto profundo en el desarrollo del campo y ha sido fundamental para avanzar en nuestra comprensión de las reacciones químicas y el comportamiento de las soluciones.
A continuación se reproduce una adaptación de la conferencia dada por Jacobus van’t Hoff con ocasión de la entrega del galardón. Algunos de los términos y conceptos corresponden al conocimiento de la epoca.
Presión osmótica y equilibrio químico
Aunque las investigaciones sobre las cuales se va a hablar fueron realizadas 15 años de la entrega del primer Premio Nobel de Química, se comenzará por describir estudios aún anteriores, aquellos que, de hecho, constituyeron la base de los propios. Estos estudios se refieren a la determinación experimental de la presión osmótica.
¿Qué es la presión osmótica? Cuando una solución, por ejemplo, de azúcar en agua, se separa del solvente puro, en este caso, agua, por una membrana que permite el paso del agua, pero no del azúcar, entonces el agua se abre camino a través de la membrana hacia la solución. Este proceso resulta naturalmente en una mayor presión en el lado de la membrana hacia el cual el agua penetra, es decir, hacia el lado de la solución.
Esta presión es la presión osmótica.
Es gracias a esta presión osmótica que la savia del roble asciende hasta las ramitas más altas. Esta presión era conocida desde principios del siglo XIX, pero hace apenas más de 20 años que este fenómeno ha sido objeto de mediciones precisas. Fue el botánico Pfeffer quien midió por primera vez esta presión en 1877, creando una membrana que cumplía con las siguientes tres condiciones: era permeable al agua, impermeable al azúcar y resistía la presión, que no era en absoluto despreciable, a la que estaba sometida.
Las fuerzas osmóticas son, de hecho, sorprendentemente grandes: con una solución de azúcar al 1%, equivalen a nada menos que 2/3 atmósferas.
Así, Pfeffer midió la presión osmótica, pero no pudo encontrar la relación entre el valor de esta presión y la concentración de la solución, su temperatura, etc. Planteó este problema al célebre físico Clausius en Bonn, pero él también fue incapaz de descubrir interrelaciones regulares. Por lo tanto, los resultados de Pfeffer quedaron en un artículo botánico especializado, escapando así a la atención de científicos de otros campos.
Importancia de la presión osmótica
La importancia de una solución a este problema se hace evidente cuando se recuerda el papel vital desempeñado por la presión osmótica en la vida de las plantas y los animales. Las membranas de la célula son, de hecho, permeables al agua, pero no a las sustancias disueltas en el fluido celular. Por lo tanto, la presión osmótica puede desarrollarse en las células.
Fue el botánico Hugo de Vries en particular quien enfatizó su importancia en la vida de las plantas: Tal presión (turgor) debe existir en las células de la planta para que no se marchiten; en otras palabras, es esencial para el crecimiento. Así, las plantas se marchitan no solo cuando pierden agua por evaporación, sino también cuando están rodeadas por una solución acuosa de sal común, cloruro de potasio, cloruro de magnesio, azúcar u otra sustancia, si la solución tiene una presión osmótica más alta, mientras que no se marchitan si la presión osmótica es más baja. El punto crítico se puede determinar con mucha precisión con la ayuda de un microscopio, y así De Vries encontró un método para establecer cuán concentrada debe estar una solución para tener la misma presión osmótica que las células de la planta, es decir, si debe ser «isotónica» con ellas.
Donders y Hamburger descubrieron luego que la presión osmótica desempeña un papel igualmente importante en la vida animal que en la vida vegetal. La vida de los animales superiores depende de los eritrocitos. Estas son células que, en relación con la presión osmótica del líquido que las rodea, se comportan de manera similar a las células vegetales, es decir, si la presión osmótica externa es demasiado grande, ocurre un fenómeno similar al marchitamiento. Y en ese momento fue especialmente notable que las soluciones encontradas como isotónicas en este sentido también eran isotónicas para la célula vegetal.
Por último, en química, la presión osmótica es muy importante porque, entre otras cosas, se puede relacionar directamente con lo que se conoce como afinidad química. En la unión del agua de cristalización, por ejemplo, se puede imaginar que el yeso natural, cuya fórmula química es CaSO4·2H2O, une su agua de cristalización de casi la misma manera que la célula vegetal retiene el agua en su interior, y la fuerza con la que esto ocurre se puede medir de la misma manera que De Vries midió la fuerza osmótica de las células.
Si se coloca sucesivamente un trozo de selenita transparente en soluciones acuosas de concentración creciente de cualquier sustancia, finalmente llega un punto en el cual el yeso ya no puede retener su agua, sino que la cede a la solución de mayor presión osmótica: «se marchita». La fuerza con la que el yeso une su agua, por lo tanto, se puede medir directamente mediante la presión osmótica.
Modelando la presión osmótica
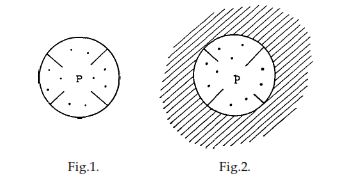
En el estudio posterior de los procesos en este campo, se descubrió la ley en torno a la cual se centró el trabajo ganador del premio. Se encontró, específicamente, que, con soluciones suficientemente diluidas, la presión osmótica era la misma que la presión de gas, es decir, la presión que la sustancia disuelta ejercería como gas. En cierta medida, esto es obvio: al igual que se imagina que la presión de gas P surge como resultado del movimiento de las moléculas y de sus colisiones con las paredes (Fig. 1), así se puede imaginar que la presión osmótica p surge como resultado de las colisiones de las moléculas disueltas con la membrana semipermeable (Fig. 2) rodeada por el solvente (indicado por sombreado).
Sin importar de todas formas una concepción hipotética sobre la causa de esta presión, se descubrió que, bajo las mismas circunstancias, es decir, con el mismo número de moléculas en el mismo volumen y a la misma temperatura, las presiones también eran las mismas. Esto puede expresarse matemáticamente mediante la ecuación p=P.
La presión osmótica es igual a la presión del gas. A partir de esta fórmula, es posible calcular teóricamente el valor encontrado por Pfeffer: 2/3 atm. para una solución de azúcar al 1%. Sin embargo, se descubrió que un grupo relativamente pequeño de soluciones, todas ellas acuosas, de ácidos, bases y sales, conocidas como electrolitos (por ejemplo, soluciones de cloruro de sodio o cloruro de potasio, es decir, principalmente aquellas que se investigaron primero), constituían una excepción. En el caso de estas, la ley no se aplicaba. La presión osmótica era i veces mayor que el valor teórico, y consecuentemente, se utilizó la siguiente fórmula durante un tiempo para estas excepciones:
p=iP
Se retornará a este punto más adelante. En el caso de los no electrolitos, esto se reduce a la primera ecuación, ya que i = 1.
Equilibrio químico
Ahora se aplicará la relación básica y se considerará lo que se conoce como equilibrio químico. Se debe hacer una distinción entre reacciones completas e incompletas, según el estado final en el cual resulta una reacción química. Después de que la dinamita ha explotado, no se encuentra ni el más mínimo rastro de la sustancia original. La reacción es completa. En otros casos, sin embargo, la reacción cesa antes de una transformación completa, por ejemplo, cuando el metanol y el ácido fórmico se convierten en agua y formiato de metilo según la ecuación:
Se podría elaborar una fórmula similar también para la explosión de dinamita. Sin embargo, en la reacción que acaba de ser formulada, solo se forman 2/3 de la cantidad posible de los productos del lado derecho. La razón de esto es que no solo se producen formato de metilo y agua a partir de metanol y ácido fórmico, sino que, inversamente, metanol y ácido fórmico se producen nuevamente a partir de formato de metilo y agua. Esto se puede ilustrar en la fórmula mediante la introducción del signo de reacción reversible en lugar del signo de igualdad:
Entonces, tales transformaciones tienen lugar en ambas direcciones: el estado final se conoce como equilibrio químico. Las leyes que rigen este equilibrio químico en el caso de sustancias disueltas pueden deducirse ahora mediante el uso de la relación básica para la presión osmótica. La primera de estas leyes, Determina la cantidad del producto que se formará en un volumen dado a partir de cantidades dadas de sustancias que reaccionan entre sí, siempre que se conozca una única constante de equilibrio, llamada K.
Dado que el valor i entra en esta fórmula en el caso de electrolitos, podemos observar que desempeña un papel importante en las leyes pertinentes del equilibrio.
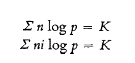
En la segunda ley, encontramos otro factor que afecta el equilibrio, a saber, la temperatura T (llamada temperatura absoluta). W es la cantidad de calor liberada durante la reacción.
Finalmente, en la última fórmula también se tiene en cuenta la cantidad de trabajo realizado durante una reacción química, por ejemplo, una explosión de dinamita, y esta cantidad está vinculada con las constantes de equilibrio.
Después de esta breve excursión matemática, nos dirigiremos a algunos de los resultados que se obtuvieron posteriormente mediante estas fórmulas.
Resultados de los trabajos de van’t Hoff
I. Ahora es fácil determinar el peso molecular de sustancias disueltas. Hace quince años, solo era posible evaluar el peso molecular de sustancias gaseosas. Gracias a la presión osmótica, ahora también es posible determinar el peso molecular de sustancias disueltas. Pero no solo los líquidos han entrado en el rango de determinación del peso molecular.
Además, las mezclas homogéneas, como las mezclas isomórficas de sustancias sólidas, son comparables a las soluciones, y las leyes de la ósmosis pueden, por lo tanto, extenderse a sustancias sólidas. En consecuencia, ahora es posible determinar el peso molecular no solo en el estado gaseoso, sino también en el líquido y en el estado sólido de agregación. El problema de la determinación del peso molecular se ha resuelto en cierta medida.
Los resultados son muy interesantes. A menudo se pensaba que, durante la transición de la fase gaseosa a la líquida, varias moléculas de gas se unen para formar una molécula líquida, y que las moléculas en el estado sólido de agregación consisten en complejos aún más grandes. En realidad, sin embargo, la situación es muy simple. En realidad, solo en casos excepcionales se han encontrado moléculas que consisten en dos moléculas de gas de la sustancia en un estado líquido o sólido de agregación, mientras que hasta el momento no se ha encontrado ninguna sustancia que forme agregados de tres moléculas de gas.
II. La segunda ecuación fue inicialmente el punto crítico en la teoría. Si Arrhenius no hubiera tenido éxito en demostrar la causa de estas excepciones y, por lo tanto, en reducir las primeras ecuaciones.
III. No es necesario profundizar en la ecuación 3. Coincide esencialmente con la ley de acción de masas formulada por los dos noruegos Guldberg y Waage, excepto en lo que respecta a i y n (número de moléculas que participan en la reacción).
IV. La cuarta ecuación vincula la constante de equilibrio químico K con el calor W liberado por la reacción. Por supuesto, puede ser probada experimentalmente y de hecho ha sido confirmada experimentalmente. Un corolario de esta ley muestra cómo el equilibrio químico varía con la temperatura, es decir, cómo, al aumentar la temperatura, se forma más de un compuesto a expensas del otro, o viceversa.
Este corolario se puede enunciar de la siguiente manera: a baja temperatura, el mayor rendimiento es siempre del producto cuya formación va acompañada de la liberación de calor. En la mayoría de los casos, de hecho, el equilibrio a temperatura ambiente se ha desplazado tanto a favor de aquellos productos que están situados en un lado de las flechas en la fórmula química que no se puede detectar rastro alguno de los productos en el otro lado.
Un ejemplo de esto es la formación de agua a partir de una mezcla de oxígeno e hidrógeno, el llamado gas oxihidrógeno. A temperatura ambiente, el equilibrio está tan inclinado hacia el lado del agua que el gas oxihidrógeno no se puede detectar en absoluto. A temperaturas más altas, hay un desplazamiento hacia el gas; se establece un equilibrio medible entre agua, oxígeno e hidrógeno. La fórmula mencionada anteriormente abarca así los procesos de disociación que fueron estudiados por Deville y Deprez.
V. Solo muy recientemente ha sido posible probar experimentalmente la quinta ecuación. Bredig y Knüpfer han determinado K a partir del equilibrio y también han determinado mediante métodos químicos el trabajo realizado durante la reacción.
En conclusión, una observación oportuna. Mientras que la aplicación de las leyes de la ósmosis ha resultado muy fructífera en el campo de la química, lo que De Vries y Donders enfatizaron hace 15 años, a saber, que la presión osmótica juega un papel fundamental en la vida vegetal y animal, ha sido plenamente confirmado desde entonces.
La determinación de la presión osmótica y de la disminución asociada del punto de congelación de las soluciones ya es frecuentemente de gran importancia en fisiología y medicina, por ejemplo, en el estudio de enfermedades. Sin embargo, el descubrimiento peculiar hecho muy recientemente por Loeb es el más importante de todos.
Este científico ha estado estudiando el problema de la fertilización, que está tan estrechamente relacionado con el problema de la vida, y ha encontrado que los huevos de erizos de mar se desarrollarán como resultado de la acción temporal de una presión osmótica específica provocada por soluciones de cloruro de potasio, cloruro de magnesio, azúcar, etc.
Para más información The Nobel Prize in Chemistry 1901
Como citar este artículo:
APA: (2024-08-29). Premio Nobel de Química 1901. Recuperado de https://quimicafacil.net/premios-nobel/premio-nobel-de-quimica-1901/
ACS: . Premio Nobel de Química 1901. https://quimicafacil.net/premios-nobel/premio-nobel-de-quimica-1901/. Fecha de consulta 2025-04-26.
IEEE: , "Premio Nobel de Química 1901," https://quimicafacil.net/premios-nobel/premio-nobel-de-quimica-1901/, fecha de consulta 2025-04-26.
Vancouver: . Premio Nobel de Química 1901. [Internet]. 2024-08-29 [citado 2025-04-26]. Disponible en: https://quimicafacil.net/premios-nobel/premio-nobel-de-quimica-1901/.
MLA: . "Premio Nobel de Química 1901." https://quimicafacil.net/premios-nobel/premio-nobel-de-quimica-1901/. 2024-08-29. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net