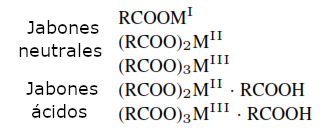Tiempo de lectura estimado: 12 minutos
El jabón por definición es una sal de un ácido graso que se utiliza en diversos productos de limpieza y lubricación. En el ámbito doméstico, los jabones son tensioactivos que suelen utilizarse para lavar, bañarse y otros tipos de tareas domésticas. En el ámbito industrial, los jabones se utilizan como espesantes, componentes de algunos lubricantes y precursores de catalizadores.
Cuando se utiliza para la limpieza, el jabón solubiliza las partículas y la suciedad, que pueden separarse del artículo que se está limpiando. En el lavado de manos, como tensioactivo, cuando se enjabona con un poco de agua, el jabón mata a los microorganismos desorganizando su bicapa lipídica de membrana y desnaturalizando sus proteínas. También emulsiona los aceites, permitiendo que sean arrastrados por el agua corriente.
El jabón se crea mezclando grasas y aceites con una base, a diferencia del detergente, que se crea combinando compuestos químicos.
El ser humano ha utilizado el jabón durante milenios. Existen pruebas de la producción de materiales similares al jabón en torno al 2800 a.C. en la antigua Babilonia.
¿Que tipos de jabón hay?
Al ser sales de ácidos grasos, los jabones tienen la fórmula general (RCO2–)nMn+ (donde R es un alquilo, M es un metal y n es la carga del catión). La clasificación principal de los jabones viene determinada por la identidad del Mn+.
Cuando M es Na o K, los jabones se denominan jabones de tocador, utilizados para el lavado de manos. Muchos dicationes metálicos (Mg2+, Ca2+ y otros) dan jabón metálico. Cuando M es litio, el resultado es el jabón de litio (por ejemplo, estearato de litio), que se utiliza en las grasas de alto rendimiento.
Jabones que no son de tocador (jabones metálicos)
Los llamados jabones metálicos son componentes clave de la mayoría de las grasas lubricantes y espesantes. Las grasas suelen ser emulsiones de jabón de calcio o jabón de litio y aceite mineral. También son útiles muchos otros jabones metálicos, como los de aluminio, sodio y sus mezclas. Estos jabones también se utilizan como espesantes para aumentar la viscosidad de los aceites. En la antigüedad, las grasas lubricantes se fabricaban añadiendo cal al aceite de oliva.
Los jabones metálicos también se incluyen en las formulaciones de las pinturas al óleo de los artistas modernos como modificadores reológicos.
Originalmente, el término jabón metálico sólo se utilizaba para las sales metálicas de los ácidos grasos de las grasas animales naturales (principalmente el sebo y la manteca) y las grasas vegetales. En la actualidad, se entiende que los jabones metálicos se refieren a las sales poco solubles o insolubles de los ácidos carboxílicos alifáticos saturados e insaturados, de cadena recta y ramificada, con 8 a 22 átomos de carbono.
Los ejemplos son ácidos grasos saturados como el ácido esteárico (ácido octadecanoico), el ácido láurico (ácido dodecanoico), el ácido 12-hidroxiesteárico y las mezclas de ácidos con 8 – 22 átomos de carbono; ácidos grasos insaturados como el ácido oleico (ácido cis-9-octadecenoico) y el ácido linoleico (ácido 9,12-octadecadienoico); ácidos carboxílicos sintéticos como el ácido isoesteárico, el ácido 2-etilhexanoico, los ácidos dimetilhexanoico y trimetilhexanoico; y las mezclas de ácidos isocarboxílicos alifáticos sintéticos.
Las sales de los ácidos nafténicos alicíclicos y de los ácidos resínicos (ácido abiético) también se consideran con frecuencia jabones metálicos debido a las propiedades relacionadas con su fabricación y aplicaciones. Sin embargo, las sales metálicas de los ácidos resínicos (resinatos) ya no tienen gran relevancia. Los ácidos nafténicos son un subproducto de la refinación del petróleo. El subproducto es una mezcla de hidrocarburos alifáticos lineales y cíclicos que contienen grupos de ácido carboxílico.
La producción y las propiedades de los jabones de casi todos los metales están descritas en la literatura. Sin embargo, sólo tienen importancia industrial los jabones metálicos de los siguientes metales: litio, potasio, sodio (grupo 1); magnesio, calcio, bario (grupo 2); circonio (grupo 4); manganeso (grupo 7); hierro (grupo 8); cobalto (grupo 9); níquel (grupo 10); cobre (grupo 11); zinc, cadmio (grupo 12); aluminio (grupo 13); plomo (grupo 14); así como cerio y mezclas de tierras raras.
La mayoría de los jabones metálicos se preparan por neutralización de ácidos grasos purificados

Usos y propiedades de los jabones metálicos
Los jabones metálicos se utilizan como espesantes para aceites y otros medios orgánicos, como lubricantes y agentes desmoldantes, así como agentes secantes (secadores). Los secantes son jabones metálicos que aceleran el secado como, por ejemplo, en la formación de la capa de las pinturas basadas en aceites secantes y resinas alquídicas.
Los jabones metálicos se utilizan como eliminadores de ácidos y lubricantes tanto interna como externamente en poliolefinas y PVC. Por su parte, los jabones de sodio y magnesio son importantes como aditivos en las industrias farmacéutica y cosmética, así como en la industria de la construcción. Los jabones de litio son especialmente importantes como componentes de las grasas lubricantes.
Las propiedades fisicoquímicas de los jabones metálicos están determinadas por la naturaleza del ion metálico y del ácido orgánico. Los jabones metálicos de los ácidos carboxílicos de cadena recta saturada son sólidos y tienen un punto de fusión agudo o un rango de fusión, o se carbonizan al calentarlos sin fundirse. Los productos pastosos contienen agua. Los ácidos grasos insaturados y los ácidos sintéticos ramificados forman jabones metálicos con propiedades plásticas. Por ello, suelen producirse y utilizarse en solución.
Tipos de jabones metálicos
Los metales pueden formar los siguientes jabones metálicos en función de su valencia y propiedades:
Los jabones ácidos contienen ácido orgánico libre ligado que puede ser eliminado por extracción.
En los jabones básicos (RCOO)2MII(MO)x (x =1,-2), los óxidos metálicos complejados también pueden estar presentes en forma de hidróxidos metálicos o como mezclas de óxidos metálicos e hidróxidos.
Los jabones mixtos (RCOO)(R’COO)MII consisten en cristales mixtos o mezclas producidas mecánicamente.
Jabones complejos: El plomo puede formar sales básicas complejas: (PbO)xPbSO4[(RCOO)2Pb]y. También pueden estar presentes otros aniones inorgánicos en lugar del sulfato.
Jabones de tocador
En el ámbito doméstico, «jabón» suele referirse a lo que técnicamente se llama jabón de tocador, utilizado para la limpieza doméstica y personal. Cuando se utiliza para la limpieza, el jabón solubiliza las partículas y la suciedad, que luego pueden separarse del artículo que se está limpiando. Las moléculas insolubles de aceite/grasa se asocian dentro de micelas, pequeñas esferas formadas por moléculas de jabón con grupos polares hidrofílicos (que atraen el agua) en el exterior y que encierran una bolsa lipofílica (que atrae la grasa), que protege las moléculas de aceite/grasa del agua haciéndolas solubles. Todo lo que sea soluble será arrastrado por el agua.
Producción de jabón de tocador
La producción de jabones de tocador suele implicar la saponificación de los triglicéridos, que son aceites y grasas vegetales o animales. Una solución alcalina (a menudo lejía o hidróxido de sodio) induce la saponificación, por lo que las grasas de los triglicéridos se hidrolizan primero en sales de ácidos grasos. Se libera glicerol (glicerina). La glicerina puede permanecer en el producto de jabón como agente suavizante, aunque a veces se separa.

Dependiendo de la naturaleza del álcali utilizado en su producción, los jabones tienen propiedades distintas. El hidróxido de sodio (NaOH) produce un «jabón duro»; los jabones duros también pueden utilizarse en aguas que contengan sales de Mg, Cl y Ca. Por el contrario, los jabones de potasio (derivados del KOH) son jabones blandos.
La fuente de ácidos grasos también afecta al punto de fusión del jabón. La mayoría de los primeros jabones duros se fabricaban con grasas animales y KOH extraído de la ceniza de madera; estos eran mayoritariamente sólidos. Sin embargo, la mayoría de los jabones modernos se fabrican a partir de triglicéridos poliinsaturados, como los aceites vegetales. Al igual que los triglicéridos de los que están formados, las sales de estos ácidos tienen fuerzas intermoleculares más débiles y, por tanto, puntos de fusión más bajos. Los jabones de litio también suelen ser duros. Se utilizan exclusivamente en las grasas.
Para fabricar jabones de tocador, los triglicéridos (aceites y grasas) se obtienen de los aceites de coco, oliva o palma, así como del sebo. El triglicérido es el nombre químico de los triésteres de los ácidos grasos y la glicerina. El sebo, es decir, la grasa extraída, es el triglicérido más disponible de los animales.
Cada especie ofrece un contenido de ácidos grasos bastante diferente, lo que da lugar a jabones de tacto distinto. Los aceites de semillas dan jabones más suaves . El jabón de aceite de oliva puro, a veces llamado jabón de Castilla o de Marsella, tiene fama de ser especialmente suave. El término «de Castilla» también se aplica a veces a los jabones procedentes de una mezcla de aceites, pero con un alto porcentaje de aceite de oliva.
¿Que es la saponificación?
La saponificación es un proceso que implica la conversión de grasas, aceites o lípidos en jabón y alcohol por la acción del calor en presencia de un álcali acuoso (por ejemplo, NaOH). Los jabones son sales de ácidos grasos y los ácidos grasos son monómeros de lípidos que tienen largas cadenas de carbono (al menos 10), por ejemplo, el palmitato de sodio. Las reacciones de saponificación son generalmente exotérmicas y casi totalmente irreversibles.
Los aceites vegetales y las grasas animales son las materias tradicionales que se saponifican. Estos materiales grasos, trímeros llamados triglicéridos, son mezclas derivadas de diversos ácidos grasos. Los triglicéridos pueden convertirse en jabón en un proceso de uno o dos pasos.
En el proceso tradicional de un paso, el triglicérido se trata con una base fuerte (por ejemplo, lejía), que escinde el enlace éster, liberando sales de ácidos grasos (jabones) y glicerol. Este proceso es también el principal método industrial para producir glicerol. En algunos casos de fabricación de jabón, el glicerol se deja en el jabón. Si es necesario, el jabón puede precipitarse salándolo con cloruro de sodio.
En el proceso de dos pasos, primero se realiza la hidrólisis del triglicerido empleando calor o un catalizador adecuado y posteriormente se separan los ácidos grasos que se saponifican para producir el jabón.
Valor de saponificación o índice de saponificación
El valor de saponificación es la cantidad de base necesaria para saponificar una muestra de grasa. Los fabricantes de jabón formulan sus recetas con un pequeño déficit de lejía para tener en cuenta la desviación desconocida del valor de saponificación entre su lote de aceite y las medias de laboratorio.
Mecanismo de reacción de la saponificación
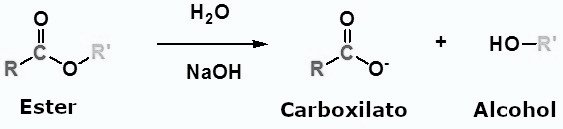
Los ésteres pueden volver a escindirse en un ácido carboxílico y un alcohol por reacción con agua y una base. La reacción se denomina saponificación, del latín sapo, que significa jabón. El nombre proviene del hecho de que el jabón solía fabricarse mediante la hidrólisis de ésteres de las grasas. Debido a las condiciones básicas, se produce un ion carboxilato en lugar de un ácido carboxílico.
Mecanismo de reacción de la saponificación
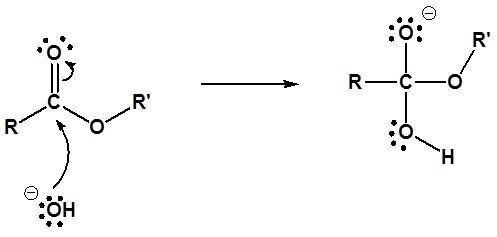
- Ataque nucleofílico por hidróxido
El anión hidróxido de la sal reacciona con el grupo carbonilo del éster. El producto inmediato se denomina ortoéster
 Anuncio
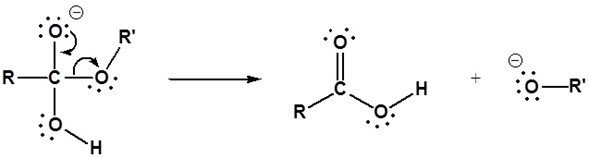
Anuncio - Expulsión del grupo saliente
La expulsión del alcóxido genera un ácido carboxílico

- Deprotonación
El ion alcóxido es una base fuerte, por lo que el protón se transfiere del ácido carboxílico al ion alcóxido creando un alcohol

En un procedimiento clásico de laboratorio, el triglicérido trimiristina se obtiene extrayéndolo de la nuez moscada con éter dietílico. La saponificación al jabón miristato de sodio tiene lugar utilizando NaOH en agua. Tratando el jabón con ácido clorhídrico se obtiene ácido mirístico.
La reacción de los ácidos grasos con la base es el otro método principal de saponificación. En este caso, la reacción implica la neutralización del ácido carboxílico.
El método de neutralización se utiliza para producir jabones industriales como los derivados del magnesio, los metales de transición y el aluminio. Este método es ideal para producir jabones derivados de un solo ácido graso, lo que da lugar a jabones con propiedades físicas predecibles, como se requiere en muchas aplicaciones.
Para más información Soap
Como citar este artículo:
APA: (2021-10-14). Química del jabón. Recuperado de https://quimicafacil.net/notas-de-quimica/quimica-del-jabon/
ACS: . Química del jabón. https://quimicafacil.net/notas-de-quimica/quimica-del-jabon/. Fecha de consulta 2026-02-27.
IEEE: , "Química del jabón," https://quimicafacil.net/notas-de-quimica/quimica-del-jabon/, fecha de consulta 2026-02-27.
Vancouver: . Química del jabón. [Internet]. 2021-10-14 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/notas-de-quimica/quimica-del-jabon/.
MLA: . "Química del jabón." https://quimicafacil.net/notas-de-quimica/quimica-del-jabon/. 2021-10-14. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net