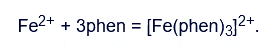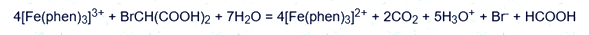Tiempo de lectura estimado: 23 minutos
- Oscilaciones químicas
- Continuando el trabajo de Belousov
- Detallando el mecanismo de reacción
- Importancia de la reacción Belousov-Zhabotinsky
- Elucidación del mecanismo de la reacción de Belousov
- Lobos y conejos
- Estudios sobre las fluctuaciones de concentración antes del descubrimiento de la reacción de Belousov
La reacción Belousov-Zhabotinsky fue descubierta por Boris Pavlovich Belousov en 1951 durante su investigación del ciclo de Krebs, en un intento por encontrar su análogo inorgánico.
En uno de sus experimentos, observó auto-oscilaciones durante la oxidación del ácido cítrico por el bromato de potasio en un medio ácido en presencia de un catalizador, iones de cerio Ce+3. El curso de la reacción cambió con el tiempo, lo que se manifestó por cambios periódicos en el color de la solución de incoloro (Ce+3) a amarillo (Ce+4) y viceversa. El efecto fue aún más pronunciado en presencia del indicador de pH ferroína.
Belousov realizó un estudio detallado de esta reacción y descubrió, entre otras cosas, que el período de las oscilaciones disminuía significativamente con el aumento de la acidez del medio y la temperatura.
Además, la reacción resultó conveniente para los estudios de laboratorio. Las oscilaciones podían ser observadas fácilmente visualmente, y su período estaba dentro del rango de 10-100 s.
El anuncio de Belousov del descubrimiento fue recibido con escepticismo en los círculos científicos nacionales, ya que se creía que las auto-oscilaciones en los sistemas químicos eran imposibles. El artículo de Belousov fue rechazado dos veces por los comités editoriales de revistas nacionales, por lo que solo pudo publicar los resultados de su investigación de la reacción oscilatoria en una forma abreviada ocho años después (en 1958) en el poco conocido «Colección de resúmenes sobre medicina de radiación», que tenía una pequeña circulación. Más tarde, este artículo se convirtió en uno de los más citados en este campo.
Actualmente se cree que la principal razón por la que los químicos rechazaron este fenómeno fue la opinión generalizada de que las oscilaciones de concentración están prohibidas fuera del equilibrio termodinámico según la segunda ley de la termodinámica.
Mientras los químicos, junto con los bioquímicos, rechazaron unánimemente las oscilaciones químicas, los matemáticos y los físicos que se interesaban por la biología seguían prestando atención a este fenómeno.
En 1952, el científico inglés A.M. Turing publicó un artículo llamado «Las bases químicas de la morfogénesis», en el que explicaba que la combinación de oscilaciones químicas con la difusión de moléculas puede llevar a la aparición de estructuras espaciales estables, donde se alternan regiones de alta y baja concentración. Turing planteó una tarea puramente teórica: ¿pueden formarse configuraciones estables de productos intermedios en un reactor en condiciones de reacción química? Y dio una respuesta afirmativa, creando un modelo matemático del proceso.
En aquel momento, su trabajo no tuvo la importancia debida, especialmente porque ni Turing ni sus colegas podían saber sobre el trabajo de Belousov y sus infructuosos intentos de publicarlo.
Oscilaciones químicas
En 1955, el físico y fisicoquímico belga Ilya Prigogine, autor de la teoría de la termodinámica de los procesos irreversibles, demostró que, en un sistema abierto cerca de un estado estacionario, alejado del equilibrio químico, son posibles las oscilaciones químicas. Fue él quien llamó la atención de la comunidad científica occidental sobre el trabajo de los científicos soviéticos. Como resultado, algunas reacciones químicas heterogéneas oscilatorias, abiertas a finales del siglo XIX, recibieron amplio reconocimiento. Fueron considerados como análogos de una serie de procesos periódicos, como los «relojes biológicos».
Los investigadores se dieron cuenta de que la segunda ley de la termodinámica no se viola en los sistemas vivos y no obstaculiza su comportamiento y evolución complejos. Pero para que exista la vida o cualquier modelo físico o químico de ella, es necesario que el sistema permanezca lo suficientemente alejado del equilibrio termodinámico durante un tiempo prolongado. Y los sistemas químicos homogéneos podrían convertirse en un modelo conveniente para estudiar dichos procesos.
Pero los trabajos de Belousov habrían sido condenados al olvido si no fuera por una feliz coincidencia. En 1958, se llevó a cabo un seminario en el Instituto de Física Química de la Academia de Ciencias de la URSS. El orador, el joven biofísico Simon Elievich Shnol, al hablar sobre los ritmos biológicos, desarrolló su hipótesis de que los relojes biológicos son controlados por reacciones químicas.
Para demostrar esto, se necesitaban ejemplos reales de oscilaciones químicas, y el orador se dirigió a la audiencia con la pregunta de si alguien podía proporcionarlos. Nadie mencionó tales ejemplos, y se expresaron algunas consideraciones sobre la imposibilidad fundamental de las oscilaciones de concentración en las reacciones químicas.
La pregunta se resolvió de manera inesperada. Después de que se cerró el seminario, cuando casi todos los participantes se habían ido, un joven estudiante de posgrado se acercó al orador y le informó que su tío había estado estudiando oscilaciones químicas hace cinco o seis años. Resultó que Shnol había estado buscando a esta persona durante mucho tiempo. El tío del estudiante de posgrado Boris Smirnov, era Boris Pavlovich Belousov.
Continuando el trabajo de Belousov
Cuando el profesor Shnol recibió la «receta» de la reacción de oscilación de Belousov y le propuso colaborar, este se negó rotundamente, aunque expresó satisfacción por el hecho de que su trabajo fuera continuado.
En 1961, el académico I.E. Tamm, el físico teórico más destacado, decidió «inspeccionar» el estado de la recién creada cátedra de biofísica de la Facultad de Física de la Universidad Estatal de Moscú. Shnol le mostró la reacción de Belousov. Esto es lo que Shnol mismo cuenta al respecto: «Igor Yevgenyevich lo vio y se detuvo por un largo tiempo, disfrutando. Luego dijo: «Bueno, ya saben, hermanos, teniendo una reacción como esta, no tienen que preocuparse: habrá suficientes misterios y trabajo por muchos años». Las palabras de Igor Yevgenyevich tuvieron un efecto en muchos. Tolya Zhobotinsky del primer grupo, un físico hereditario, como él mismo se describía, decidió trabajar en la reacción.
Shnol apoyó al joven científico y le propuso al estudiante de posgrado A.M. Zhobotinsky comenzar investigaciones sobre el mecanismo de la reacción de Belousov, con las que éste se entusiasmó y se dedicó a ellas. «Una característica notable de las obras de Zhobotinsky y del grupo de colaboradores que se formó a su alrededor, – recuerda Shnol, – fue la combinación de experimentos químicos, métodos de registro físico y la construcción de modelos matemáticos.
En estos modelos – sistemas de ecuaciones diferenciales – las constantes cinéticas se sustituían por datos experimentales. Después de esto, se podían comparar las grabaciones experimentales de oscilaciones con las curvas que se obtenían mediante la simulación computacional».
El grupo de Zhobotinsky llevó a cabo investigaciones detalladas sobre la reacción, incluyendo sus diferentes variantes. Zhobotinsky propuso el primer mecanismo de la reacción y un modelo matemático simple que era capaz de demostrar el comportamiento oscilatorio. Los principales resultados se presentaron en el libro de A.M. Zhobotinsky «Concentrational Autowaves»
Detallando el mecanismo de reacción
Posteriormente, el mecanismo fue ampliado y refinado, se calcularon teóricamente los regímenes dinámicos observados experimentalmente, incluyendo los caóticos, y se demostró su correspondencia con el experimento. La lista completa de etapas elementales de la reacción es muy complicada y consta de casi cien reacciones con docenas de sustancias e intermediarios. Hasta ahora, el mecanismo detallado es desconocido, especialmente las constantes de velocidad de las reacciones.
En 1969, Zhabotinsky y sus colegas descubrieron que, si se coloca la mezcla reactiva en una capa delgada y plana, se producen ondas de cambio de concentración que son visibles a simple vista en presencia de indicadores.
El rápido y exitoso estudio de la reacción de Belousov-Zhabotinsky funcionó en la ciencia como un disparador: inmediatamente recordaron que antes ya se conocían procesos similares. Sin embargo, el valor de la reacción de Belousov, según el profesor B.V. Volter, quien por cierto fue el primero en señalar la importancia de las reacciones oscilatorias en los procesos químico-tecnológicos industriales, radicaba no en la prioridad, sino en la simplicidad y claridad del experimento, y finalmente, en los resultados obtenidos mediante esta interesante transformación realizada por A.M. Zhabotinsky, A.N. Zaikin, E.E. Sel’kov y otros. Si nos remontamos al pasado, las primeras descripciones de oscilaciones en sistemas de concentración se remontan al siglo XIX.
Importancia de la reacción Belousov-Zhabotinsky
La reacción de Belousov-Zhabotinsky se convirtió en una de las reacciones químicas más famosas en la ciencia, y es objeto de investigación por parte de numerosos científicos y grupos de diversas disciplinas y áreas científicas en todo el mundo: matemáticas, química, física, biología.
Se han descubierto numerosos análogos en diferentes sistemas químicos (por ejemplo, el análogo de fase sólida: la síntesis de alta temperatura autodifusora). Se han publicado miles de artículos y libros, y se han defendido muchas tesis de maestría y doctorado.
El descubrimiento de la reacción prácticamente impulsó el desarrollo de áreas modernas de la ciencia como la sinergética, la teoría de sistemas dinámicos y el caos determinista.
Ahora se conocen varias reacciones similares a la de Belousov-Zhabotinsky. Bajo este nombre se agrupa toda una clase de sistemas químicos relacionados, cercanos en mecanismo, pero diferentes en los catalizadores utilizados (Ce3+, Mn2+ y complejos de Fe2+, Ru2+), los reductores orgánicos (ácido malónico, ácido bromomalónico, ácido cítrico, ácido málico, etc.) y los oxidantes (bromatos, iodatos, etc.).
En ciertas condiciones, estos sistemas pueden mostrar formas de comportamiento muy complejas, desde oscilaciones periódicas regulares hasta caos, y son un objeto importante de investigación para las leyes universales de los sistemas no lineales. En particular, fue en la reacción de Belousov-Zhabotinsky donde se observó el primer extraño atractor experimental en sistemas químicos y se realizó una comprobación experimental de sus propiedades teóricamente predichas.
Elucidación del mecanismo de la reacción de Belousov
Volviendo a la consideración de la esencia de la reacción oscilatoria homogénea, Belousov utilizó ácido cítrico y como par oxidante-reductor, derivados de cerio. Su discípulo y colaborador, A.P. Safronov, sugirió agregar al líquido complejos de hierro con fenantrolina.
En estas condiciones, el cambio de color fue espectacular: de un rojo-lila a un azul brillante. Zhabotinsky, quien se dedicó a estudiar detalladamente el mecanismo de la reacción, demostró definitivamente que la reacción autooscilatoria puede tener lugar incluso si el ácido cítrico es reemplazado por cualquier otro ácido dicarbono con un grupo metileno activo, y si el par redox catalítico Ce(IV)/Ce(III) es reemplazado por el par Mn(III)/Mn(II) o, como ya lo había utilizado Belousov, el par ferroína/ferrína.
La combinación más elegante y estética se logra utilizando ácido malónico y iones de hierro Fe2+ en lugar de iones de cerio. En este caso, la solución en el matraz puede cambiar de color con una estricta periodicidad durante horas, en todo el rango visible de colores desde rojo rubí hasta celeste-azul. La ecuación formal de la reacción parece bastante simple, sin embargo, la reacción transcurre en más de 20 etapas y, por lo tanto, con la formación de una cantidad igual de productos intermedios. Examinemos más detalladamente esta reacción.
Para ello, se preparan dos soluciones, A y B.
La solución A es una solución de ferroína, un complejo de hierro(II) con o-fenantrolina (fen) – [Fe(phen)3]2+:
La solución puede prepararse con antelación.
La solución B es solución de ácido bromomalónico (preparada inmediatamente antes de la demostración):
El ácido bromomalónico formado es inestable, pero puede almacenarse a baja temperatura durante algún tiempo.
Para la demostración del experimento, se coloca una placa de Petri sobre una placa de vidrio que cubre la ventana de luz, en la que se añaden sucesivamente con pipetas una solución saturada de bromato potásico, una solución de ácido bromomalónico y una solución de ferroína. En pocos minutos aparecen manchas azules sobre el fondo rojo del vaso. Esto se debe a la formación de otro complejo ferrieno [Fe(phen)3]3+ durante la reacción redox del complejo ferroína [Fe(phen)3]2+ con iones bromato:
Este proceso avanza con autocatálisis. Luego, el complejo [Fe(phen)3]3+ formado oxida el ácido bromomalónico, formando iones bromuro:
Los iones bromuro liberados actúan como inhibidores de la reacción de oxidación del complejo de hierro(II) por iones de bromato. Solo cuando la concentración de [Fe(phen)3]2+ se vuelve lo suficientemente alta, se supera la acción inhibitoria de los iones bromuro y las reacciones de formación de ácido bromomalónico y oxidación del complejo comienzan de nuevo. El proceso se repite y esto se refleja en el color de la solución. Las áreas azules en la caja dan lugar a «ondas» de color rojo-azul concéntricas y circulares que se propagan en todas las direcciones.
Si se agitaba el contenido del vaso de precipitados con una varilla de vidrio, la solución se volverá de un solo color por un corto período de tiempo, luego el proceso periódico se repetirá. Eventualmente, la reacción se detendrá debido a la liberación de dióxido de carbono. Si se agregan algunos cristales de nitrato de cerio (III) hexahidratado a la placa de Petri además de todos los reactivos mencionados, el rango de colores se ampliará: aparecerá el color amarillo debido a los derivados de cerio (IV) y verde debido a la superposición de los colores azul y amarillo.
La descripción matemática de estos procesos resultó ser bastante complicada. Llevó a resultados inesperados. Se descubrió que uno de los esquemas químicos más simples que describe las oscilaciones en el sistema de dos reacciones autocatalíticas secuenciales es matemáticamente idéntico a las ecuaciones que el científico italiano V. Volterra utilizó a principios de la década de 1930 para describir procesos ecológicos.
Actualmente, este es el conocido modelo de Lotka-Volterra, que describe cambios periódicos en la cantidad de «presas» y «depredadores» en sistemas ecológicos. S.P. Mushtakova, profesor de la Universidad Estatal de Saratov N.G. Chernyshevsky, considera la reacción oscilatoria como la interacción de dos sistemas, uno de los cuales obtiene la energía, sustancias u otros componentes necesarios para su desarrollo del otro. Este problema se llama problema de los depredadores y las presas.
Lobos y conejos
Para ilustrar, imaginemos que en un entorno limitado habitan lobos y conejos. En este sistema ecológico crece hierba, de la cual se alimentan los conejos, que a su vez son la comida de los lobos. Se sabe que, si se tiene cualquier conjunto de seres vivos, bajo condiciones favorables, su población aumentará ilimitadamente. En realidad, factores externos como la falta de energía o alimento limitan este proceso de crecimiento.
Supongamos que, hasta cierto punto, la interacción entre los dos subsistemas, es decir las poblaciones de lobos y conejos, estaba equilibrada: había suficientes conejos (teniendo en cuenta su crecimiento natural) para alimentar a un número determinado de lobos. Luego, en un momento determinado, que se toma como punto cero en el tiempo, debido a alguna fluctuación, el número de conejos aumentó. Esto aumentó la cantidad de alimento para los lobos y, por lo tanto, su número. Surgió una fluctuación en la cantidad de lobos.
Además, la cantidad de lobos y liebres cambiará periódicamente en el tiempo alrededor de un valor medio (equilibrio). Los lobos saciados comienzan a reproducirse intensivamente, dando a luz a nuevas crías que, gracias a la abundante comida, crecen rápidamente y generan más descendencia. Se crea una situación en la que el «criadero de liebres» ya no puede alimentar a todos los lobos: la población de liebres comienza a disminuir, mientras que la de lobos (hasta cierto punto) sigue aumentando. Finalmente, el ecosistema está sobrepoblado de lobos y las liebres están casi en peligro de extinción. Pero, al convertirse en una rareza ecológica, las liebres se vuelven difíciles de atrapar para los lobos.
El ecosistema entra en la siguiente fase: la cantidad de liebres ha disminuido a un nivel mínimo en el que son casi inalcanzables para los lobos. La población de estos últimos, después de alcanzar un máximo, comienza a reducirse y esta disminución continúa hasta que se alcanza un nivel que las liebres pueden alimentar en su mínimo. Ahora, cuando la cantidad de lobos ha alcanzado su mínimo, no hay nadie para cazar a las liebres. Las liebres comienzan a reproducirse y la escasa población de lobos ya no puede seguirles el rastro. La cantidad de liebres en un corto período de tiempo alcanzará un nivel en el que podrán alimentarse de la hierba. Una vez más, hay abundancia de liebres.
¿Cuáles son las conclusiones que se pueden sacar al comparar este ejemplo con la reacción oscilatoria?
Destaquemos los puntos principales, sin los cuales el proceso oscilatorio descrito sería imposible.
En primer lugar, el comportamiento cooperativo de las moléculas en solución es imposible sin retroalimentación. El significado de esto se puede entender mediante el ejemplo de la interacción entre conejos y lobos: el aumento en el número de depredadores conduce a una disminución en la población de presas, y viceversa. La presencia de tal retroalimentación garantiza la existencia estable del ecosistema.
Si se describen las reacciones químicas oscilatorias en términos de «depredador-presa», entonces el papel de los «depredadores» lo desempeñan los productos intermedios, que ralentizan o bloquean por completo etapas individuales del proceso, es decir, los inhibidores. Los catalizadores, que aceleran la reacción, desempeñan el papel de «presa». Aunque, como se sabe, las propias moléculas del catalizador (Fe) no se consumen en la reacción, la proporción de concentraciones de iones [Fe2+] / [Fe3+], como han demostrado las investigaciones, experimenta una evolución complicada. Este esquema simplificado permite presentar en términos generales el mecanismo molecular de retroalimentación en solución.
En segundo lugar, el proceso oscilatorio es imposible sin una fuente de energía, que en el modelo de Lotka-Volterra fue desempeñada por la hierba que comían los conejos. Es evidente que no puede haber oscilaciones ni estabilidad en el ciclo «depredador-presa» si se cementa todo el territorio de la reserva – los lobos comerán a los conejos y luego morirán ellos mismos. En la reacción de Belousov-Zhabotinsky, la fuente de energía es el ácido malónico orgánico. De hecho, cuando se oxida completamente, las oscilaciones en la reacción disminuyen y luego la propia reacción se detiene.
Para 1963, la fase principal cualitativa del estudio de la reacción de Belousov había terminado. El científico era consciente de ello, pero decidió no involucrarse en el trabajo. En marzo de 1966 se convocó el primer simposio pan-soviético sobre procesos oscilatorios en química y bioquímica. Los informes de Zhábotinski y sus colaboradores – M.D. Korzujina, V.A. Vavilina ocuparon un lugar central. Belousov se negó a participar en el simposio.
Más tarde, en 1974, el profesor de química y biología de la Universidad de Arizona, A.T. Winfree, descubrió estructuras espaciotemporales en el sistema de Belousov-Zhabotinsky inmiscible, que se originan y existen como diferentes patrones espaciales de dos y tres dimensiones (por ejemplo, anillos concéntricos, espirales, frentes de onda, etc.). Desde entonces, el interés en estos sistemas ha ido en aumento, lo que indica la perspectiva de la investigación en esta área.
Así, las investigaciones con enfoque aplicado están adquiriendo cada vez más peso, por ejemplo, en el campo de la modelización de alternativas de procesamiento de información (en particular, el análisis de mosaicos complejos con gradación de brillo de objetos). Otra nueva dirección en la investigación aplicada es el estudio de las características de la polimerización en el sistema Belousov-Zhabotinsky o similar a él.
La compleja organización espacio-temporal mostrada por el sistema de reacción de Belousov-Zhabotinsky (BZ) en ausencia de mezcla ha encontrado analogías en la naturaleza, en sistemas biológicos (por ejemplo, el estudio de la fibrilación del músculo cardíaco desde la perspectiva de considerar el miocardio como un sistema biológico autoorganizado).
Hasta ahora, la reacción de Belousov-Zhabotinsky ha ocupado un lugar destacado en la ciencia mundial. De hecho, estimuló la aparición de un nuevo campo científico: la sinergética (autoorganización), y los trabajos experimentales iniciaron el desarrollo de la teoría moderna de los sistemas dinámicos. Aunque en la actualidad se sabe mucho sobre estas reacciones, las causas que provocan los procesos químicos oscilatorios siguen sin estar completamente claras. La descripción dinámica de las reacciones químicas oscilatorias puede ser de gran ayuda para establecer de manera indirecta las constantes de velocidad de las reacciones que faltan.
Estudios sobre las fluctuaciones de concentración antes del descubrimiento de la reacción de Belousov
Resulta que una de las primeras publicaciones sobre oscilaciones químicas data de 1828. En ella, T. Fechner presentó los resultados de la investigación de las oscilaciones de una reacción electroquímica. En 1833, V. Herschel publicó una investigación similar sobre las oscilaciones de una reacción heterogénea catalítica. El trabajo más interesante es el de M. Rosenfeld de 1834. El autor notó completamente por casualidad que un pequeño frasco que contenía un poco de fósforo emitía una luz bastante intensa en la oscuridad. El hecho de que esta luz se repitiera regularmente cada siete segundos era interesante.
El trabajo de Rosenfeld describe en detalle el estudio de la luz intermitente en el frasco. Cuarenta años después, el francés M. Jubert continuó estos experimentos con la «botella intermitente». Logró observar la formación periódica de «nubes luminosas» en un tubo de ensayo. Veinte años después, el científico alemán A. Zentnershver también investigó el efecto de la presión del aire en los destellos periódicos del fósforo.
En sus experimentos, el período de los destellos comenzó en 20 segundos y disminuyó con la disminución de la presión. Al mismo tiempo, en Inglaterra, los químicos T. Thorpe y A. Tutton observaron destellos periódicos de la reacción de oxidación del trióxido de fósforo en un recipiente de vidrio sellado.
Una página especialmente notable en la historia de las oscilaciones químicas está relacionada con los llamados anillos de Liesegang. En 1896, el químico alemán R. Liesegang, experimentando con fotocromos, descubrió que si se dejaba caer tinta china sobre una placa de vidrio cubierta con gelatina que contenía cromato, el producto de la reacción que se precipitaba se dispone en la placa en círculos concéntricos.
Liesegang se fascinó con este fenómeno y pasó casi medio siglo investigándolo. También se encontró una aplicación práctica. En el arte aplicado, los anillos de Liesegang se utilizaron para decorar diversos objetos con imitación de jade, malaquita, ágata, etc. Liesegang mismo propuso una tecnología para la producción de perlas artificiales.
Sin embargo, el descubrimiento de Liesegang, que tuvo un gran impacto en los círculos científicos de la química, no fue el primero. Los estudios de las ondas químicas ya se habían llevado a cabo antes de él, y en 1855 se publicó el libro de F. Runge, que recopilaba numerosos ejemplos de tales experimentos.
Se puede continuar la lista de ejemplos similares. Después de los mencionados, se descubrieron reacciones oscilatorias en la frontera entre dos fases. Entre ellas, las más conocidas son las reacciones en la interfaz metal-solución, que recibieron nombres específicos: «nervio de hierro» y «corazón de mercurio». La primera de ellas, la reacción de disolución de hierro (alambre) en ácido nítrico, recibió su nombre por su similitud externa con la dinámica de un nervio excitado, observado por V.F. Ostwald.
La segunda, o una de sus variantes, es la reacción de descomposición de H2O2 en la superficie de mercurio metálico. En la reacción, se produce la formación y disolución periódica de una película de óxido en la superficie del mercurio. Las oscilaciones de la tensión superficial del mercurio causan pulsaciones rítmicas de la gota, que recuerdan a los latidos del corazón. Sin embargo, todas estas reacciones no atrajeron mucha atención de los químicos, ya que la comprensión del curso de las reacciones químicas aún era bastante vaga.
Solo en la segunda mitad del siglo XIX surgieron la termodinámica y la cinética química, sentando las bases para un interés específico en las reacciones oscilatorias y los métodos para su análisis. Al mismo tiempo, fue el desarrollo de la termodinámica del equilibrio lo que inicialmente sirvió como obstáculo para el estudio de tales procesos. El problema aparentemente radicaba en la «inercia del conocimiento previo».
Según el profesor Schmoller, «una persona educada no podía imaginar la ordenación macroscópica en el movimiento térmico desordenado de una enorme cantidad de moléculas: todas las moléculas están en un estado, ¡luego en otro! Es como admitir la existencia de una máquina de movimiento perpetuo. Esto no puede ser. Y de hecho, no puede ser tan cerca del estado de equilibrio, que es lo único que la termodinámica de aquellos años estaba considerando».
Sin embargo, no había limitaciones en los modos complejos, incluidos los oscilatorios, para los sistemas químicos no equilibrados, donde las reacciones aún no se han completado y las concentraciones de los reactivos no han alcanzado niveles de equilibrio. Pero este hecho escapó de la atención de los químicos… Se necesitó un esfuerzo intelectual extraordinario para liberarse de las «cadenas de hierro del conocimiento completo» y estudiar el comportamiento de los sistemas lejos del equilibrio.
Sin embargo, en 1910 el italiano A. Lotka predijo la posibilidad de oscilaciones en sistemas químicos basándose en el análisis de un sistema de ecuaciones diferenciales. Sin embargo, los primeros modelos matemáticos solo correspondían a oscilaciones amortiguadas. Fue solo diez años después que Lotka propuso un sistema con dos reacciones autocatalíticas consecutivas, y en este modelo las oscilaciones podrían ser sostenidas.
No obstante, las posiciones de los físicos y químicos divergieron aquí. Uno de los logros más destacados de la física y las matemáticas del siglo XX fue la creación de la teoría de las oscilaciones. Aquí, los físicos soviéticos tienen grandes méritos reconocidos. En 1928, el estudiante de postgrado A.A. Andronov, futuro académico, presentó un informe sobre «Ciclos límite de Poincaré y la teoría de las oscilaciones autoinducidas» en un congreso de físicos.
A principios de la década de 1930, en el Instituto de Física Química de la Academia de Ciencias de la URSS, se descubrieron oscilaciones de luminiscencia en «llamas frías», similares a la luminiscencia oscilatoria de vapores de fósforo, que interesaron al famoso físico D.A. Frank-Kamenetskii, quien explicó estas oscilaciones basándose en el modelo cinético de Lotka. Y en 1947, en el mismo instituto, se presentó para su defensa una tesis sobre «La teoría de la progresión periódica de las reacciones químicas homogéneas», escrita por I.E. Salnikov bajo la dirección científica de Frank-Kamenetskii.
Esta tesis contenía amplia información sobre la historia de más de un siglo del estudio de las oscilaciones químicas y los primeros resultados de su investigación teórica utilizando los métodos de la teoría de las oscilaciones no lineales desarrollada por la escuela del académico Andronov. Sin embargo, no fue defendida en ese momento. Según Voltaire, «los trabajos de Frank-Kamenetskii y Salnikov sobre las auto-oscilaciones químicas, presentados en la tesis, en el libro y en una serie de artículos, fueron sin duda innovadores para la ciencia química de la época.
Pero esta innovación era comprensible para muy pocos. La ‘ideología oscilatoria’ (término de Andronov) era ajena a la cotidianidad no oscilatoria de la ciencia y la práctica química, y esto puede explicar el hecho de que los trabajos de Frank-Kamenetskii y Salnikov en la década de 1940 fueron rechazados, y cuando se produjo el redescubrimiento de las oscilaciones químicas, nadie se acordó de ellos». Permanece un misterio si Belousov tenía conocimiento de estos trabajos. En cualquier caso, en sus dos artículos no se hacen referencias a los trabajos de sus predecesores.
Para más información What Everyone Should Know About the Belousov-Zhabotinsky Reaction
Como citar este artículo:
APA: (2023-07-13). La reacción de Belousov-Zhabotinsky. Recuperado de https://quimicafacil.net/notas-de-quimica/la-reaccion-belousov-zhabotinsky/
ACS: . La reacción de Belousov-Zhabotinsky. https://quimicafacil.net/notas-de-quimica/la-reaccion-belousov-zhabotinsky/. Fecha de consulta 2025-07-05.
IEEE: , "La reacción de Belousov-Zhabotinsky," https://quimicafacil.net/notas-de-quimica/la-reaccion-belousov-zhabotinsky/, fecha de consulta 2025-07-05.
Vancouver: . La reacción de Belousov-Zhabotinsky. [Internet]. 2023-07-13 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/notas-de-quimica/la-reaccion-belousov-zhabotinsky/.
MLA: . "La reacción de Belousov-Zhabotinsky." https://quimicafacil.net/notas-de-quimica/la-reaccion-belousov-zhabotinsky/. 2023-07-13. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net